

2023 , Vol. 20 >Issue 09: 911 - 915
DOI: https://doi.org/10.3877/cma.j.issn.1672-6488.2023.09.004
高帧频超声造影评价肝细胞癌血管形态与风险因素的研究
Copy editor: 吴春凤
收稿日期: 2023-06-01
网络出版日期: 2023-12-11
版权
Evaluation of relationsip between vascular morphology and risk factors for hepatocellular carcinoma by high-frame-rate contrast-enhanced ultrasound
Received date: 2023-06-01
Online published: 2023-12-11
Copyright
探索高帧频超声造影(H-CEUS)检查肝细胞癌(HCC)动脉期血流灌注的不同形态特征及其与风险因素的关系。
回顾2021年1月至2022年6月在解放军总医院第一医学中心行手术治疗的HCC患者78例,所有患者术前均行常规超声与H-CEUS检查。根据H-CEUS动脉早期灌注形成的血管形态进行分型,并采用χ2检验比较不同HCC分化程度、有无微血管侵犯(MVI)和不同肿瘤大小组间血管形态的差异。
H-CEUS显示HCC动脉期血管形态可以分为4型,其中Ⅰ型31例(39.7%),Ⅱ型1例(1.3%),Ⅲ型14例(18.0%),Ⅳ型32例(41.0%)。78例HCC患者中,高-中高分化HCC有19例(24.3%),中分化HCC有46例(59.0%),中低-低分化HCC有13例(16.7%);23例(29.5%)病灶存在MVI,55例(70.5%)无MVI;直径≤3 cm的病灶有41例(52.6%),>3 cm的病灶有37例(47.4%)。不同HCC分化程度、有无MVI、不同肿瘤大小组间血管形态分型分布差异具有统计学意义(χ2=13.04、11.92、19.25,P=0.023、=0.004、<0.001),Ⅳ型血管形态在中低-低分化组(84.6%)、MVI组(65.2%)及>3 cm HCC组(62.2%)占比更高。对于≤3 cm HCC,MVI组与无MVI组间的血管形态差异也具有统计学意义(χ2=9.00,P=0.015),Ⅳ型血管形态在MVI组占比(54.5%)更高。
H-CEUS可以显示HCC动脉期的不同微血管形态,不同风险因素组间血管形态存在差异,H-CEUS可能为术前判断肿瘤分化程度及MVI风险提供可靠的影像学参考。
李淼 , 朱连华 , 韩鹏 , 姜波 , 费翔 . 高帧频超声造影评价肝细胞癌血管形态与风险因素的研究[J]. 中华医学超声杂志(电子版), 2023 , 20(09) : 911 -915 . DOI: 10.3877/cma.j.issn.1672-6488.2023.09.004
To explore the relationship between different vascular morphological characteristics and risk factors for hepatocellular carcinoma (HCC).
This retrospective study enrolled 78 patients with single hepatocellular carcinoma (HCC) who underwent surgery at the First Medical Centre, Chinese PLA General Hospital from January 2021 to June 2022. All patients underwent ultrasound and high-frame-rate contrast-enhanced ultrasound scanning before surgery. According to the differences of vascular morphology on high-frame-rate contrast-enhanced ultrasound in the arterial phase, the patients were divided into different groups to compare the relationship between vascular morphology and degree of differentiation, microvascular invasion (MVI), and tumor size in each group by the Chi-square test.
Vascular morphology of HCC in the arterial phase can be divided into four types by high-frame-rate contrast-enhanced ultrasound, including type Ⅰ in 31 (39.7%) cases, type Ⅱ in 1 (1.3%), type Ⅲ in 14 (18.0%), and type Ⅳ in 32 (41.0%). Among the 78 HCC patients included, 19 (24.3%) had well or well-to-moderately differentiated HCC, 46 (59.0%) had moderately differentiated HCC, and 13 had moderately-to-poorly or poorly differentiated HCC (16.7%); 23 (29.5%) had MVI and 55 (70.5%) had no MVI; 41 (52.6%) had a lesion ≤3 cm diameter and 37 (47.4%) had a lesion >3 cm diameter. There were statistical differences in vascular morphology according to HCC differentiation degree, MVI, and tumor size (χ2=13.04, P=0.023; χ2=11.92, P=0.004; χ2=19.25, P<0.001), and there was a significant higher proportion of type Ⅳ vascular morphology in the moderate-poor and poor differentiation group (84.6%), MVI group (65.2%), and >3 cm diameter group (62.2%). For HCC with a diameter≤3 cm, there was a statistical difference between the MVI group and the non-MVI group in vascular morphology (χ2=9.00, P=0.015), and type Ⅳ vascular morphology had a higher percentage in the MVI group (54.5%).
High-frame-rate contrast-enhanced ultrasound can display different vascular morphologies of HCC in the arterial phase, and there are differences in vascular morphology among different risk factor groups. High-frame-rate contrast-enhanced ultrasound may be a feasible imaging technique to determine the degree of tumor differentiation and MVI risk before surgery.
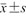 表示;病灶最大直径为不符合正态分布的计量资料,以M(QR)表示。性别、病理结果、超声图像特征等为计数资料,采用频数(%)表示,采用χ2检验比较组间差异。以P<0.05为差异具有统计学意义。
表示;病灶最大直径为不符合正态分布的计量资料,以M(QR)表示。性别、病理结果、超声图像特征等为计数资料,采用频数(%)表示,采用χ2检验比较组间差异。以P<0.05为差异具有统计学意义。表1 不同情况HCC患者动脉早期造影灌注形成的血管形态比较[例(%)] |
| 项目 | 例数 | Ⅰ型 | Ⅱ型 | Ⅲ型 | Ⅳ型 | χ2值 | P值 |
|---|---|---|---|---|---|---|---|
| 微血管侵犯 | 11.92 | 0.004 | |||||
| 有 | 23 | 8(34.8) | 0(0) | 0(0) | 15(65.2) | ||
| 无 | 55 | 23(41.8) | 1(1.8) | 14(25.5) | 17(30.9) | ||
| 肿瘤大小 | 19.25 | <0.001 | |||||
| 小HCC | 41 | 25(61.0) | 1(2.4) | 6(14.6) | 9(22.0) | ||
| 大HCC | 37 | 6(16.2) | 0(0) | 8(21.6) | 23(62.2) | ||
| 分化程度 | 13.04 | 0.023 | |||||
| 高-中高分化 | 19 | 10(52.6) | 0(0) | 4(21.1) | 5(26.3) | ||
| 中分化 | 46 | 20(43.5) | 1(2.2) | 9(19.5) | 16(34.8) | ||
| 中低-低分化 | 13 | 1(7.7) | 0(0) | 1(7.7) | 11(84.6) |
注:HCC为肝细胞癌 |
表2 不同微血管侵犯组小肝细胞癌患者动脉早期造影灌注形成的血管形态比较[例(%)] |
| 组别 | 例数 | Ⅰ型 | Ⅱ型 | Ⅲ型 | Ⅳ型 |
|---|---|---|---|---|---|
| 有微血管侵犯组 | 11 | 5(45.5) | 0(0) | 0(0) | 6(54.5) |
| 无微血管侵犯组 | 30 | 20(66.7) | 1(3.3%) | 6(20.0) | 3(10.0) |
| χ2值 | 9.00 | ||||
| P值 | 0.015 | ||||
| 1 |
|
| 2 |
|
| 3 |
赫捷, 陈万青, 沈洪兵, 等. 中国人群肝癌筛查指南(2022,北京) [J]. 临床肝胆病杂志, 2022, 38(8): 1739-1758, 1954-1967.
|
| 4 |
|
| 5 |
|
| 6 |
|
| 7 |
|
| 8 |
|
| 9 |
|
| 10 |
|
| 11 |
|
| 12 |
|
| 13 |
|
| 14 |
|
| 15 |
|
| 16 |
|
| 17 |
|
| 18 |
|
| 19 |
|
| 20 |
|
| 21 |
|
| 22 |
|
| 23 |
|
/
| 〈 |
|
〉 |