

2024 , Vol. 21 >Issue 07: 709 - 717
DOI: https://doi.org/10.3877/cma.j.issn.1672-6448.2024.07.012
超声矢量血流成像对2型糖尿病患者颈动脉壁剪切应力的研究
Copy editor: 吴春凤
收稿日期: 2023-12-12
网络出版日期: 2024-07-09
基金资助
四川省科技厅重点研发计划(2022YFS0247)
四川省留学回国人员科技活动项目择优资助项目
版权
Evaluation of wall shear stress of the carotid artery by ultrasound vector flow imaging in patients with type 2 diabetes mellitus
Received date: 2023-12-12
Online published: 2024-07-09
Copyright
探究2型糖尿病(T2DM)患者颈总动脉(CCA)壁剪切应力(WSS)的特征,以及WSS检测T2DM患者发生心血管疾病(CVD)的应用价值。
选取2020年11月至2021年2月于四川省人民医院接受治疗的49例T2DM患者作为DM组及19例健康志愿者作为对照组,并根据DM组患者有无高血压(HPT)分为DM+HPT组(26例)和DM+非HPT组(23例),根据是否伴有CVD分为DM+CVD组(15例)和DM+非CVD组(34例)。所有受试者均行常规颈动脉超声检查,并应用超声矢量血流(V-Flow)成像技术检测CCA中段、近分叉处及分叉处的最大壁剪切应力(WSSmax)和平均壁剪切应力(WSSmean)。DM组和对照组之间比较采用t检验;亚组之间超声参数的比较采用单因素方差分析,其中两两比较采用SNK检验;采用受试者操作特征(ROC)曲线分析T2DM患者合并CVD的超声诊断参数。
与对照组相比,DM组患者CCA中段及近分叉处的WSSmean降低[中段:(0.81±0.23)Pa vs (1.02±0.21)Pa;近分叉处:(0.73±0.21)Pa vs (0.90±0.16)Pa],差异具有统计学意义(t=-3.451、-3.127,P=0.001、0.003)。在亚组分析中,DM+非HPT组CCA中段和近分叉处的WSSmean仍小于对照组[中段:(0.87±0.24)Pa vs (1.02±0.21)Pa;近分叉处:(0.78±0.18)Pa vs (0.90±0.16)Pa],差异具有统计学意义(P均<0.05)。DM+CVD组CCA中段及近分叉处WSSmean明显小于DM+非CVD组[中段:(0.71±0.18)Pa vs (0.85±0.23)Pa;近分叉处:(0.62±0.20)Pa vs (0.78±0.20)Pa],差异具有统计学意义(P均<0.05)。ROC曲线分析显示CCA近分叉处的WSSmean对T2DM患者发生CVD具有诊断价值(曲线下面积为0.699,P<0.05)。
T2DM患者CCA中段和近分叉处的WSSmean低于正常人,在合并CVD患者中降低更明显,近分叉处的WSSmean在检测T2DM患者发生CVD方面具有潜在临床应用价值。
曹雯佳 , 刘学兵 , 罗安果 , 钟释敏 , 邓岚 , 王玉琳 , 李赵欢 . 超声矢量血流成像对2型糖尿病患者颈动脉壁剪切应力的研究[J]. 中华医学超声杂志(电子版), 2024 , 21(07) : 709 -717 . DOI: 10.3877/cma.j.issn.1672-6448.2024.07.012
To investigate the characteristics of common carotid artery (CCA) wall shear stress (WSS) in patients with type 2 diabetes mellitus (T2DM) and the application value of WSS in detecting cardiovascular disease (CVD) in such patients.
A total of 49 T2DM patients treated at Sichuan People's Hospital from November 2020 to February 2021 were selected as a DM group and 19 healthy volunteers as a control group. Patients in the DM group were further divided into a DM+HPT group and a DM+non-HPT group according to whether they had hypertension (HPT) or not, and a DM+CVD group and a DM+non-CVD group according to whether they had CVD or not. All subjects underwent conventional carotid ultrasound examination, and ultrasound vector flow imaging (V-Flow) was applied to examine the maximum wall shear stress (WSSmax) and mean wall shear stress (WSSmean) at the bifurcation, proximal bifurcation, and middle region of the CCA. The comparison between the DM group and control group was performed by the t test. The comparison of ultrasonic parameters between subgroups was performed by one-way ANOVA, and the SNK test was used for pairwise comparisons. The ultrasonic diagnostic parameters of T2DM patients with CVD were analyzed by using the receiver operating characteristic (ROC) curve.
Compared with the control group, the WSSmean in the middle region and proximal bifurcation of the CCA was decreased in the DM group [middle region: (0.81±0.23) Pa vs (1.02±0.21) Pa; proximal bifurcation: (0.73±0.21) Pa vs (0.90±0.16) Pa; P<0.05 for both]. In subgroup analysis, WSSmean in the middle region and proximal bifurcation of the CCA in the DM+non-HPT group was still lower than that of the control group [middle region: (0.87±0.24) Pa vs (1.02±0.21) Pa; proximal bifurcation: (0.78±0.18) Pa vs (0.90±0.16) Pa; P<0.05 for both]. WSSmean in the middle region and proximal bifurcation of the CCA in the DM+CVD group was significantly lower than that of the DM+non-CVD group [middle region: (0.71±0.18) Pa vs (0.85±0.23) Pa; proximal bifurcation: (0.62±0.20) Pa vs (0.78±0.20) Pa; P<0.05 for both]. ROC curve analysis showed that WSSmean at the proximal bifurcation of the CCA was a validated diagnostic parameter for CVD in T2DM patients (area under the curve: 0.699, P<0.05).
WSSmean in the middle region and proximal bifurcation of the CCA in T2DM patients is lower than that of healthy people, and the decrease is more obvious in patients with CVD. WSSmean in the proximal bifurcation is a valuable parameter for detecting the occurrence of CVD in T2DM patients.
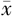 ±s表示,若方差齐采用独立样本t检验比较DM组和对照组的差异,若方差不齐采用t'检验比较DM组和对照组的差异;亚组之间以及CCA不同节段之间计量资料的比较采用单因素方差分析,其中两两比较采用SNK检验。通过受试者操作特征(receiver operating characteristic,ROC)曲线分析T2DM患者合并CVD的超声诊断参数。应用双侧检验,P<0.05为差异具有统计学意义。
±s表示,若方差齐采用独立样本t检验比较DM组和对照组的差异,若方差不齐采用t'检验比较DM组和对照组的差异;亚组之间以及CCA不同节段之间计量资料的比较采用单因素方差分析,其中两两比较采用SNK检验。通过受试者操作特征(receiver operating characteristic,ROC)曲线分析T2DM患者合并CVD的超声诊断参数。应用双侧检验,P<0.05为差异具有统计学意义。表1 DM组和对照组一般临床资料比较 |
| 资料 | DM组(n=49) | 对照组(n=19) | 统计值 | P值 |
|---|---|---|---|---|
| 年龄(岁) | 63.47±11.87 | 57.42±12.36 | t=-1.863 | 0.067 |
| 男性[例(%)] | 25(51.0) | 11(57.9) | χ2=0.260 | 0.610 |
BMI(kg/m2,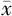 ±s) ±s) | 25.17±3.24 | 22.88±2.83 | t=-2.519 | 0.014 |
收缩压(mmHg,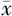 ±s) ±s) | 141±21 | 122±13 | t=-3.228 | <0.001 |
舒张压(mmHg,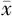 ±s) ±s) | 79±11 | 72±7 | t=-2.674 | 0.010 |
心率(次/min,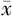 ±s) ±s) | 85±14 | 79±9 | t=-1.853 | 0.071 |
TG(mmol/L,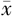 ±s) ±s) | 2.06±1.18 | 1.34±0.58 | t=-1.940 | 0.058 |
TC(mmol/L,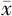 ±s) ±s) | 4.83±1.21 | 4.49±1.01 | t=-.837 | 0.406 |
LDL-C(mmol/L,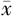 ±s) ±s) | 2.63±0.92 | 2.51±0.70 | t=-.388 | 0.700 |
HDL-C(mmol/L,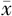 ±s) ±s) | 1.17±0.35 | 1.33±0.39 | t=1.242 | 0.220 |
FPG(mmol/L,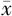 ±s) ±s) | 10.41±4.46 | 5.13±0.47 | t=-7.972 | <0.001 |
| HbA1c(%,±s) | 9.64±2.70 | 5.20±0.50 | t=-10.170 | <0.001 |
| 吸烟史[例(%)] | 16(32.7) | 1(5.3) | χ2=5.478 | 0.019 |
注:DM为糖尿病,BMI为体质量指数,TG为血清甘油三酯,TC为总胆固醇,LDL-C为低密度脂蛋白胆固醇,HDL-C为高密度脂蛋白胆固醇,FPG为空腹血糖;HbA1c为糖化血红蛋白;1 mmHg=0.133 kPa |
图2 颈总动脉不同节段壁剪切应力(WSS)测量结果。图a~c:1例糖尿病组受试者测量结果;图d~e:1例对照组受试者测量结果;图a、d为颈总动脉分叉处测量结果,图b、e为颈总动脉近分叉处测量结果,图c、f为颈总动脉中段测量结果 |
表2 DM组和对照组颈总动脉不同节段的超声参数比较( |
| 参数 | DM组(n=49) | 对照组(n=19) | t值 | P值 |
|---|---|---|---|---|
| WSSmax(Pa) | ||||
| 颈总动脉中段 | 2.38±0.47 | 2.63±0.40 | -2.041 | 0.045 |
| 颈总动脉近分叉处 | 2.14±0.47a | 2.21±0.34a | -0.607 | 0.546 |
| 颈总动脉分叉处 | 1.69±0.60ab | 1.62±0.22ab | 0.473 | 0.638 |
| F值 | 22.379 | 44.015 | ||
| P值 | <0.001 | <0.001 | ||
| WSSmean(Pa) | ||||
| 颈总动脉中段 | 0.81±0.23 | 1.02±0.21 | -3.451 | 0.001 |
| 颈总动脉近分叉处 | 0.73±0.21 | 0.90±0.16 | -3.127 | 0.003 |
| 颈总动脉分叉处 | 0.53±0.18ab | 0.55±0.11ab | -0.482 | 0.631 |
| F值 | 23.551 | 39.714 | ||
| P值 | <0.001 | <0.001 | ||
| CD(cm) | ||||
| 颈总动脉中段 | 0.64±0.08 | 0.59±0.05 | 2.218 | 0.030 |
| 颈总动脉近分叉处 | 0.67±0.09 | 0.63±0.05 | 2.459 | 0.017 |
| 颈总动脉分叉处 | 0.74±0.14ab | 0.77±0.08ab | -1.125 | 0.265 |
| F值 | 10.456 | 40.999 | ||
| P值 | <0.001 | <0.001 | ||
| Vp(cm/s) | ||||
| 颈总动脉中段 | 0.61±0.13 | 0.68±0.12 | -2.123 | 0.038 |
| 颈总动脉近分叉处 | 0.49±0.14a | 0.51±0.09a | -0.644 | 0.522 |
| 颈总动脉分叉处 | 0.43±0.13a | 0.42±0.09ab | 0.779 | 0.439 |
| F值 | 17.847 | 29.728 | ||
| P值 | <0.001 | <0.001 | ||
| IMTmean(mm) | ||||
| 颈总动脉中段 | 0.85±0.14 | 0.73±0.12 | 3.085 | 0.003 |
| 颈总动脉近分叉处 | 0.99±0.17 | 0.88±0.11 | 2.489 | 0.015 |
| t值 | -4.105 | -5.183 | ||
| P值 | <0.001 | 0.001 | ||
| IMTsd(mm) | ||||
| 颈总动脉中段 | 0.08±0.05 | 0.05±0.02 | 3.843 | <0.001 |
| 颈总动脉近分叉处 | 0.09±0.04 | 0.07±0.02 | 2.548 | 0.013 |
| t值 | -1.237 | -2.422 | ||
| P值 | 0.197 | 0.018 |
注:WSSmax为最大壁剪切应力;WSSmean为平均壁剪切应力;CD为颈动脉直径;Vp为峰值速度;IMTmean为内中膜厚度平均值;IMTsd为内中膜厚度标准差。a与颈总动脉中段比较,差异具有统计学意义(P<0.05);b与颈总动脉近分叉处比较,差异具有统计学意义(P<0.05) |
表3 DM+HPT、DM+非HPT组及对照组颈总动脉不同节段的超声参数比较 |
| 参数 | DM+HPT组(n=26) | DM+非HPT组(n=23) | 对照组(n=19) | F值 | P值 |
|---|---|---|---|---|---|
| WSSmax(Pa) | |||||
| 颈总动脉中段 | 2.37±0.50 | 2.41±0.44 | 2.63±0.40 | 2.091 | 0.132 |
| 颈总动脉近分叉处 | 2.12±0.56 | 2.17±0.37 | 2.21±0.34 | 0.251 | 0.779 |
| 颈总动脉分叉处 | 1.82±0.77 | 1.55±0.27 | 1.62±0.22 | 1.800 | 0.173 |
| WSSmean(Pa) | |||||
| 颈总动脉中段 | 0.77±0.21a | 0.87±0.24a | 1.02±0.21 | 7.540 | 0.001 |
| 颈总动脉近分叉处 | 0.69±0.24a | 0.78±0.18a | 0.90±0.16 | 6.080 | 0.004 |
| 颈总动脉分叉处 | 0.56±0.20 | 0.50±0.16 | 0.55±0.11 | 1.020 | 0.366 |
| CD(cm) | |||||
| 颈总动脉中段 | 0.67±0.08ab | 0.61±0.08 | 0.59±0.05 | 6.474 | 0.003 |
| 颈总动脉近分叉处 | 0.69±0.08a | 0.65±0.09 | 0.63±0.05 | 4.108 | 0.021 |
| 颈总动脉分叉处 | 0.71±0.15 | 0.78±0.14 | 0.77±0.08 | 1.794 | 0.174 |
| Vp(cm/s) | |||||
| 颈总动脉中段 | 0.60±0.12 | 0.62±0.15 | 0.68±0.12 | 2.380 | 0.101 |
| 颈总动脉近分叉处 | 0.49±0.14 | 0.50±0.14 | 0.51±0.09 | 0.222 | 0.802 |
| 颈总动脉分叉处 | 0.47±0.16 | 0.43±0.10 | 0.42±0.09 | 0.912 | 0.407 |
| IMTmean(mm) | |||||
| 颈总动脉中段 | 0.88±0.14a | 0.83±0.16a | 0.73±0.12 | 5.716 | 0.005 |
| 颈总动脉近分叉处 | 1.01±0.19a | 0.97±0.16 | 0.88±0.11 | 3.485 | 0.036 |
| IMTsd(mm) | |||||
| 颈总动脉中段 | 0.08±0.05a | 0.08±0.04a | 0.05±0.02 | 3.860 | 0.026 |
| 颈总动脉近分叉处 | 0.10±0.05 | 0.09±0.05 | 0.07±0.02 | 2.063 | 0.135 |
注:DM为糖尿病;HPT为高血压;WSSmax为最大壁剪切应力;WSSmean为平均壁剪切应力;CD为颈动脉直径;Vp为峰值速度;IMTmean为内中膜厚度平均值;IMTsd为内中膜厚度标准差。a与对照组相比,差异具有统计学意义(P<0.05);b与DM+非HPT组相比,差异具有统计学意义(P<0.05) |
表4 DM+CVD、DM+非CVD组及对照组颈总动脉不同节段的超声参数比较 |
| 参数 | DM+CVD组(n=15) | DM+非CVD组(n=34) | 对照组(n=19) | F值 | P值 |
|---|---|---|---|---|---|
| WSSmax(Pa) | |||||
| 颈总动脉中段 | 2.31±0.50 | 2.41±0.44 | 2.63±0.40 | 2.302 | 0.108 |
| 颈总动脉近分叉处 | 1.96±0.46 | 2.22±0.46 | 2.21±0.34 | 2.072 | 0.134 |
| 颈总动脉分叉处 | 1.95±0.94 | 1.58±0.32 | 1.62±0.22 | 2.853 | 0.065 |
| WSSmean(Pa) | |||||
| 颈总动脉中段 | 0.71±0.18ab | 0.85±0.23a | 1.02±0.21 | 8.305 | 0.001 |
| 颈总动脉近分叉处 | 0.62±0.20ab | 0.78±0.20a | 0.90±0.16 | 8.953 | <0.001 |
| 颈总动脉分叉处 | 0.57±0.22 | 0.51±0.16 | 0.55±0.11 | 0.732 | 0.485 |
| CD(cm) | |||||
| 颈总动脉中段 | 0.67±0.08ab | 0.62±0.08 | 0.59±0.05 | 4.754 | 0.012 |
| 颈总动脉近分叉处 | 0.70±0.09a | 0.66±0.08 | 0.63±0.05 | 3.380 | 0.040 |
| 颈总动脉分叉处 | 0.67±0.15 | 0.77±0.13 | 0.77±0.08 | 3.397 | 0.040 |
| Vp(cm/s) | |||||
| 颈总动脉中段 | 0.60±0.15 | 0.61±0.12 | 0.68±0.12 | 2.289 | 0.110 |
| 颈总动脉近分叉处 | 0.50±0.18 | 0.48±0.12 | 0.51±0.09 | 0.372 | 0.691 |
| 颈总动脉分叉处 | 0.48±0.18 | 0.43±0.11 | 0.42±0.09 | 0.859 | 0.428 |
| IMTmean(mm) | |||||
| 颈总动脉中段 | 0.86±0.11a | 0.85±0.16a | 0.73±0.12 | 4.696 | 0.012 |
| 颈总动脉近分叉处 | 1.03±0.16a | 0.97±0.17 | 0.88±0.11 | 4.002 | 0.023 |
| IMTsd(mm) | |||||
| 颈总动脉中段 | 0.08±0.05a | 0.07±0.05a | 0.05±0.02 | 4.102 | 0.021 |
| 颈总动脉近分叉处 | 0.10±0.06 | 0.09±0.04 | 0.07±0.02 | 2.226 | 0.116 |
注:DM为糖尿病;CVD为心血管疾病;WSSmax为最大壁剪切应力;WSSmean为平均壁剪切应力;CD为颈动脉直径;Vp为峰值速度;IMTmean为内中膜厚度平均值;IMTsd为内中膜厚度标准差。a与对照组相比,差异具有统计学意义(P<0.05);b与DM+非CVD组相比,差异具有统计学意义(P<0.05) |
| 1 |
|
| 2 |
|
| 3 |
|
| 4 |
|
| 5 |
|
| 6 |
|
| 7 |
|
| 8 |
|
| 9 |
|
| 10 |
|
| 11 |
|
| 12 |
|
| 13 |
李赵欢, 周易, 邓岚, 等. 2型糖尿病颈动脉壁剪切力分布特征及其与心脑血管疾病的关系 [J]. 中国超声医学杂志, 2021, 37(5): 485-488.
|
| 14 |
|
| 15 |
|
| 16 |
|
| 17 |
American Diabetes Association. 2. Classification and diagnosis of diabetes: standards of medical care in diabetes-2021 [J]. Diabetes Care, 2021, 44(Suppl 1): S15-S33.
|
| 18 |
|
| 19 |
|
| 20 |
|
| 21 |
|
| 22 |
|
| 23 |
|
| 24 |
|
| 25 |
|
| 26 |
|
| 27 |
|
| 28 |
|
| 29 |
|
/
| 〈 |
|
〉 |