

2024 , Vol. 21 >Issue 06: 608 - 616
DOI: https://doi.org/10.3877/cma.j.issn.1672-6448.2024.06.010
NBAV脂质纳泡对ApoE -/-小鼠动脉粥样硬化病变的评估和干预
Copy editor: 汪荣
收稿日期: 2024-04-09
网络出版日期: 2024-08-05
基金资助
唐都医院社会人才项目(2021SHRC014)
陕西省自然科学基金项目(2022JQ-835)
版权
Eualuation and intervention of annexin V nanobubbles on atherosclerotic lesions in ApoE -/- mice
Received date: 2024-04-09
Online published: 2024-08-05
Copyright
应用膜联蛋白AV脂质纳泡(AV-Nanobubbles,NBAV)评估ApoE -/-小鼠动脉粥样硬化(atherosclerosis,AS)病变并分析其对斑块内组织因子(tissue factor,TF)表达和血脂水平的影响,探讨NBAV评估、干预AS斑块及抗凝、抗血栓的潜在价值。
以高脂饲料喂养雄性ApoE -/-小鼠8~10周建立AS斑块模型鼠50只,对照组C57小鼠10只。高频超声、血管解剖及离体动脉油红O染色观察建模效果;NBAV超声造影成像观察模型鼠AS斑块特征;HE、Masson、油红O及TUNEL染色分析斑块性质。将模型鼠随机分为治疗组(n=20)和未治疗组(n=20),分别经尾静脉注射NBAV稀释液150 μl(50 μl/10g)及等量生理盐水,每5天1次,共8周。以二维超声动态观察不同治疗时间小鼠AS斑块变化情况,并取血管标本行组织学染色分析斑块内TF含量;另收集治疗后小鼠血液标本,检测血脂各项指标的变化。
高脂饮食喂养8周后,高频超声可探及ApoE -/-小鼠AS斑块回声,镜下及油红O染色显示脂肪类物质附着于血管壁。超声造影显示,相对于NBctrl(未结合AV),注射NBAV后60、120、180 s时,斑块内回声强度差异均有统计学意义[60 s:(106.33±23.0)dB vs (62.33±18.5)dB,120 s:(101.33±17.3)dB vs (41.67±10.3) dB,180s:(72.67±10.2)dB vs(22.00±5.2)dB,P均<0.01]。注射NBAV后出现高增强且持续时间长的模型鼠AS斑块,对应组织病理学检测结果显示,管壁结构不规则、排列紊乱,斑块内大量脂质积聚、蓝染的胶原纤维减少,且斑块内Tunel阳性染色区(凋亡细胞)增加,显示易损性斑块特征。NBAV连续治疗6周后,斑块区TF表达降低,与治疗0周和2周相比,TF表达的差异有统计学意义(t=14.17,P<0.001;t=7.022,P<0.01)。至第8周时,治疗组模型鼠的血脂指标甘油三酯、总胆固醇、低密度脂蛋白胆固醇水平显著低于未治疗组(P均<0.05),高密度脂蛋白胆固醇水平则高于未治疗组(P<0.05)。
NBAV具有评估AS斑块易损性,降低斑块内TF表达以及改善AS血脂的作用,NBAV对AS病变干预有潜在价值。
马晓菊 , 梁潇 , 段云友 , 袁丽君 , 赵萍 . NBAV脂质纳泡对ApoE -/-小鼠动脉粥样硬化病变的评估和干预[J]. 中华医学超声杂志(电子版), 2024 , 21(06) : 608 -616 . DOI: 10.3877/cma.j.issn.1672-6448.2024.06.010
To investigate the effect of annexin V conjugated nanobubbles (NBAV) on atherosclerotic (AS) lesions, tissue factor (TF) expression in atherosclerotic plaques, and lipid levels in ApoE -/- mice, and explore the potential value of NBAV in plaque intervention, as well as their anti-thrombotic effects.
ApoE -/- mice (n=50) were fed a high fat for 8~10 weeks to establish an atherosclerotic plaque model, and normal C57 mice (n=10) were uesed as controls. The characterization of plaques was performed by high-frequency ultrasound, microanatomy, and oil red O staining. In vivo contrast-enhanced ultrasound (CEUS) was then performed on AS plaques in ApoE -/- mice with NBAV and NBCtrl injection. After CEUS, the plaques were histopathologically assessed in vitro by hematoxylin-eosin, Masson, oil red O, and TUNEL staining. Model mice were randomly divided into a nontreatment group (n=20) and a treatment group (n=20). The treatment group was injected with 150 μl of NBAV dilution (50 μl/10 g) via the tail vein every 5 days for 8 weeks. The nontreatment group was given the same amount of normal saline. After several weeks of treatment, blood vessel samples were collected for analysis of TF expression and blood samples were collected for blood lipid analysis.
After 8 weeks of high fat feeding, ApoE -/- mice showed echo-enhanced atherosclerotic plaques, as revealed by microscopic findings and oil red O staining. Compared with mice injected with NBCtrl, in vivo CEUS showed that there was strong and sustained echo enhancement in plaque area of the aortic arch in mice with NBAV injection [60 s: (106.33±23.0) dB vs (62.33±18.5) dB; 120 s: (101.33±17.3) dB vs (41.67±10.3) dB; 180 s: (72.67±10.2) dB vs (22.00±5.2) dB, P < 0.01]. Further histopathological results showed that plaques in mice with NBAV injection presented significant pathological changes with vulnerable features and abundant TUNEL-positive area, such as irregular morphology, disordered arrangement of the vessel wall, a large amount of lipid accumulation, and a decrease in blue-dyed collagen fibers in the plaque. The positive TF staining areas in plaques began to decrease after 6 weeks of NBAV treatment, and TF expression was significantly different compared with that at 0 and 2 weeks of NBAV treatment (t =14.17, P < 0.001; t =7.022, P < 0.01). The levels of TG, TC, and LDL-c were significantly lower in mice treated with NBAV for 8 weeks than in nontreatment group (P < 0.05), while the level of HDL-c was significantly higher than that of the nontreatment group (P < 0.05).
NBAV can be used to evaluate AS plaque vulnerability and reduce TF expression within plaques and blood lipids, suggesting that NBAV have potential value in intervening in AS lesions.
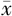 ±s表示。2组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
±s表示。2组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。图3 注射NBAV、NBCtrl脂质纳泡后不同时间点斑块内回声强度超声造影图像。图a~d为注射NBCtrl后10、60、120、180 s超声造影增强图像;图e~h为注射NBAV后10、60、120、180 s超声造影增强图像注:白色虚线圆圈为动脉粥样硬化病变感兴趣区域 |
图8 NBAV治疗后ApoE -/-小鼠动脉粥样硬化斑块的二维超声表现。图a~d分别为治疗0、2、6、8周二维超声主动脉短轴切面观察小鼠动脉粥样硬化斑块的形态及回声情况 |
表1 NBAV治疗组与非治疗组ApoE -/-模型鼠血脂生化指标比较( |
| 组别 | 数量(只) | TG | TC | LDL-c | HDL-c |
|---|---|---|---|---|---|
| 非治疗组 | 5 | 3.592±0.23 | 17.64±0.63 | 13.41±1.64 | 1.457±0.15 |
| 治疗组 | 5 | 1.250±0.09 | 12.79±0.88 | 7.631±0.55 | 2.421±0.02 |
| t值 | 9.474 | 4.472 | 4.292 | 6.399 | |
| P值 | 0.011 | 0.046 | 0.013 | 0.003 |
注:TG为甘油三酯;TC为总胆固醇;LDL-c为低密度脂蛋白胆固醇;HDL-c为高密度脂蛋白胆固醇 |
| 1 |
|
| 2 |
|
| 3 |
|
| 4 |
|
| 5 |
|
| 6 |
|
| 7 |
|
| 8 |
赵萍, 马晓菊, 陈建梅, 等. 膜联蛋白V纳米微泡抑制ox-LDL诱导的巨噬细胞组织因子表达的实验研究[J]. 中国超声医学杂志, 2021, 37(10): 1182-1185.
|
| 9 |
|
| 10 |
|
| 11 |
|
| 12 |
|
| 13 |
|
| 14 |
|
| 15 |
|
| 16 |
|
| 17 |
|
| 18 |
|
| 19 |
|
| 20 |
高梦月, 黄张建, 华子春. 膜联蛋白A5在疾病诊断与新药开发中的应用前景[J]. 药学进展, 2019, 43(1): 3-11.
|
| 21 |
中国血脂管理指南修订联合专家委员会. 中国血脂管理指南(2023年) [J]. 中国循环杂志, 2023, 38(3): 237-271.
|
| 22 |
中华医学会心血管病学分会动脉粥样硬化与冠心病学组, 中华心血管病杂志编辑委员会. 超高危动脉粥样硬化性心血管疾病患者血脂管理中国专家共识[J]. 中华心血管病杂志, 2020, 48(4): 280-286.
|
/
| 〈 |
|
〉 |