

2025 , Vol. 22 >Issue 06: 564 - 571
DOI: https://doi.org/10.3877/cma.j.issn.1672-6448.2025.06.010
USCT声速反演成像定量评估肌肉脂肪含量的实验研究
通信作者:
崔立刚,Email:cuijuegang@126.comCopy editor: 汪荣
收稿日期: 2025-05-12
网络出版日期: 2025-08-01
基金资助
国家自然科学基金(12474461)
版权
Quantitative assessment of muscle fat content using ultrasound computed tomography-based speed-of-sound inversion imaging: an experimental study
Corresponding author:
Cui Ligang, Email: cuijuegang@126.comReceived date: 2025-05-12
Online published: 2025-08-01
Copyright
利用基于全波形反演(FWI)的超声计算机断层扫描(USCT)新型成像技术定量评估肌肉脂肪含量。
选取39例离体新鲜猪后腿模型,利用环形阵列USCT系统(512阵元,0.9 MHz)进行扫描,基于频域多尺度FWI算法重建高分辨率声速图像。在得到声速图像后,根据肌肉组织与脂肪组织之间的声速差异,对图像进行分析,计算脂肪面积百分比。以病理学分析(HE染色)测量的脂肪面积百分比为金标准进行对比验证。通过Pearson相关分析及组内相关系数(ICC)、Bland-Altman图分析评估USCT与病理结果的相关性与一致性。
USCT测量的肌肉脂肪含量为(17.79±8.97)%,病理测量结果为(19.90±9.42)%。相关性分析显示,USCT与病理肌肉内脂肪含量呈显著正相关(r =0.874,P<0.001)。一致性分析显示,USCT与病理结果的ICC为0.853(95%CI:0.704~0.925,P<0.05),Bland-Altman图显示,一致性界限(LOA)为-11.22%~6.99%。USCT与病理测量的肌肉内脂肪含量存在系统性偏差(平均差值=-2.11%)。去骨后USCT成像可清晰区分皮肤、脂肪与肌肉组织,显著提升定量精度。
本研究基于声速反演的USCT技术能够有效量化肌肉脂肪含量,为肌肉退行性病变的早期诊断提供非侵入性评估新途径,并为肌骨代谢性疾病的精准影像评估奠定了重要技术基础。
唐瑞 , 李盼盼 , 李玉冰 , 崔立刚 . USCT声速反演成像定量评估肌肉脂肪含量的实验研究[J]. 中华医学超声杂志(电子版), 2025 , 22(06) : 564 -571 . DOI: 10.3877/cma.j.issn.1672-6448.2025.06.010
To utilize a novel imaging technique employing ultrasound computed tomography (USCT) integrated with full waveform inversion (FWI) for the quantitative assessment of muscle fat content.
Thirty-nine ex-vivo fresh pig hindlimb models were scanned using a ring-array USCT system (512-element, 0.9 MHz). High-resolution acoustic velocity images were reconstructed using a frequency-domain multiscale FWI algorithm. Following sound speed image acquisition, fat area percentage was calculated based on the acoustic speed difference between muscle tissue and adipose tissue. Pathological analysis (hematoxylin-eosin [HE] staining) served as the gold standard for measuring fat area percentage for comparative validation. Correlation and agreement between USCT and pathological results were assessed using Pearson correlation analysis, intraclass correlation coefficient (ICC), and Bland-Altman plot analysis.
The muscle fat content measured by USCT was (17.79±8.97)%, while the pathological measurement result was (19.90±9.42)%. Correlation analysis revealed a significant positive correlation between USCT and pathological intramuscular fat content (r = 0.874, P<0.001). Agreement analysis showed an ICC of 0.853 (95% confidence interval: 0.704-0.925, P<0.05) between USCT and pathological results. The Bland-Altman plot indicated that the limits of agreement (LOA) ranging from -11.22% to 6.99%. There was a systematic bias between USCT and pathological measurements of intramuscular fat content (mean difference=-2.11%). Post-deboning USCT imaging clearly differentiated skin, fat, and muscle tissues, significantly enhancing quantitative accuracy.
This study demonstrates that USCT technology based on sound speed inversion can effectively quantify muscle fat content. It provides a novel non-invasive approach for the early diagnosis of muscle degenerative diseases and establishes a crucial technical foundation for the precise imaging assessment of musculoskeletal metabolic disorders.
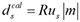 为计算域中环形阵列接收点处的合成数据,掩模矩阵
为计算域中环形阵列接收点处的合成数据,掩模矩阵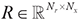 用于提取计算域中接收点的数据,ℝ表示实数集,Nr表示接收点的个数,Nx表示计算域网格点数;(3)计算上述目标函数E及其相对于声速的梯度∇mE,这里采用伴随状态法求取[16];(4)利用该梯度,结合L-BFGS最优化算法和线搜索方法,确定迭代方向D和步长α,进而更新声速模型mk+1=mk+αkDk,其中k表示当前第k次迭代;(5)将mk+1作为新的初始声速模型,进入下一次迭代。(6)多次重复(1)至(5)过程,逐步减小目标函数E的值。当迭代过程满足预设的停止条件时,即可得到一个与真实模型接近的声速重建图像。
用于提取计算域中接收点的数据,ℝ表示实数集,Nr表示接收点的个数,Nx表示计算域网格点数;(3)计算上述目标函数E及其相对于声速的梯度∇mE,这里采用伴随状态法求取[16];(4)利用该梯度,结合L-BFGS最优化算法和线搜索方法,确定迭代方向D和步长α,进而更新声速模型mk+1=mk+αkDk,其中k表示当前第k次迭代;(5)将mk+1作为新的初始声速模型,进入下一次迭代。(6)多次重复(1)至(5)过程,逐步减小目标函数E的值。当迭代过程满足预设的停止条件时,即可得到一个与真实模型接近的声速重建图像。 ±s表示,计数资料以频数及构成比表示。采用Pearson相关系数评估USCT与病理肌肉内脂肪含量的相关性,采用组内相关系数(intraclass correlation coefficient,ICC)和Bland-Altman图评估二者的一致性。以P<0.05为差异存在统计学意义。
±s表示,计数资料以频数及构成比表示。采用Pearson相关系数评估USCT与病理肌肉内脂肪含量的相关性,采用组内相关系数(intraclass correlation coefficient,ICC)和Bland-Altman图评估二者的一致性。以P<0.05为差异存在统计学意义。唐瑞,李盼盼,李玉冰,等. USCT声速反演成像定量评估肌肉脂肪含量的实验研究[J/OL].中华医学超声杂志(电子版), 2025, 22(6): 564-571.
| 1 |
尤聪瑶, 杨铁毅. 肌少症诊治研究进展 [J]. 国际骨科学杂志, 2022, 43(06): 357-361.
|
| 2 |
|
| 3 |
|
| 4 |
|
| 5 |
|
| 6 |
|
| 7 |
张元鸣飞, 吴同绚, 周谋望, 等. 定量超声技术在肌力评定中的应用 [J]. 中国康复医学杂志, 2018, 33(10): 1242-1245.
|
| 8 |
谢帅, 赵佳琦. 神经肌肉疾病骨骼肌结构与功能的定量超声研究进展 [J]. 海军军医大学学报, 2023, 44(2): 155-160.
|
| 9 |
|
| 10 |
|
| 11 |
|
| 12 |
|
| 13 |
|
| 14 |
武小晴, 李玉冰, 苏畅, 等. 基于环形阵列的肌骨超声高分辨率断层成像 [J]. 仪器仪表学报, 2024, 45(6): 208-218.
|
| 15 |
魏聪, 陈捷, 李洪涛, 等. 超声断层成像用于关节置换术后影像学评估 [J]. 中国医学影像技术, 2023, 39(3): 412-416.
|
| 16 |
|
| 17 |
郑浩, 季久秀, 周李生, 等. 猪肉肉色评分与色度值、大理石花纹评分及肌内脂肪含量回归模型的建立 [J]. 江西农业大学学报, 2019, 41(1): 124-131.
|
| 18 |
|
| 19 |
|
| 20 |
|
| 21 |
|
| 22 |
|
| 23 |
|
| 24 |
|
| 25 |
|
/
| 〈 |
|
〉 |