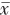资料与方法
一、对象
二、方法
三、统计学分析
结果
一、胎儿组与小儿组合并的其他心内畸形
表1 143例TOF合并心内畸形情况(例) |
| 心内合并畸形 | 胎儿组(n=70) | 小儿组(n=73) |
|---|---|---|
| 主动脉弓及头臂分支异常 | ||
| 右位主动脉弓+头臂镜像分支 | 11 | 12 |
| 右位主动脉弓+迷走左锁骨下动脉 | 5 | 0 |
| 迷走右锁骨下动脉 | 1 | 1 |
| 双主动脉弓 | 0 | 1 |
| 动脉导管异常 | ||
| 动脉导管缺如 | 13 | 0 |
| 动脉导管细窄或闭锁 | 9 | 0 |
| 动脉导管异位 | 2 | 0 |
| 动脉导管未闭 | 0 | 9 |
| 静脉异常 | ||
| 永存左上腔静脉 | 8 | 10 |
| 无名静脉弓下走行 | 1 | 2 |
| 其他动脉异常 | ||
| 细小冠状动脉-肺动脉瘘 | 0 | 1 |
| 单冠状动脉 | 0 | 1 |
| 右肺动脉异常起源于升主动脉 | 0 | 1 |
| 左侧椎动脉起自于主动脉弓 | 0 | 1 |
| 瓣膜异常 | ||
| 瓣膜黏液样变 | 1 | 0 |
| 二尖瓣闭锁 | 1 | 0 |
| 主动脉瓣二叶畸形 | 1 | 0 |
| 其他 | ||
| 卵圆孔未闭 | 0 | 16 |
| 房间隔缺损 | 0 | 12 |
| 房室间隔缺损 | 2 | 0 |
| 肌部室间隔缺损 | 0 | 5 |
| 心房反位 | 0 | 1 |
注:TOF为法洛四联症 |
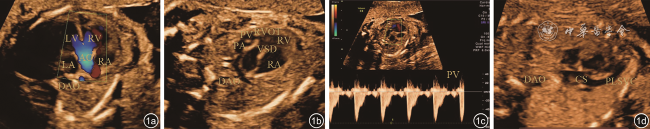
图1 法洛四联症胎儿超声心动图图像。图a为心尖五腔心切面示主动脉增宽,骑跨于室间隔之上,骑跨率约50%,彩色多普勒示双心室血液入主动脉;图b为大动脉短轴切面示室间隔缺损膜周部,室上嵴前移,致右心室流出道狭窄,肺动脉狭窄;图c示肺动脉瓣上流速;图d示永存左上腔静脉汇入冠状静脉窦注:LV为左心室;RV为右心室;AO为主动脉;DAO为降主动脉;VSD为室间隔缺损;PV为肺动脉瓣;PA为肺动脉;RA为右心房;LA为左心房;RVOT为右心室流出道;CS为冠状静脉窦;PLSVC为永存左上腔静脉 |