一、右心室-肺动脉耦联的生理机制及有创评价
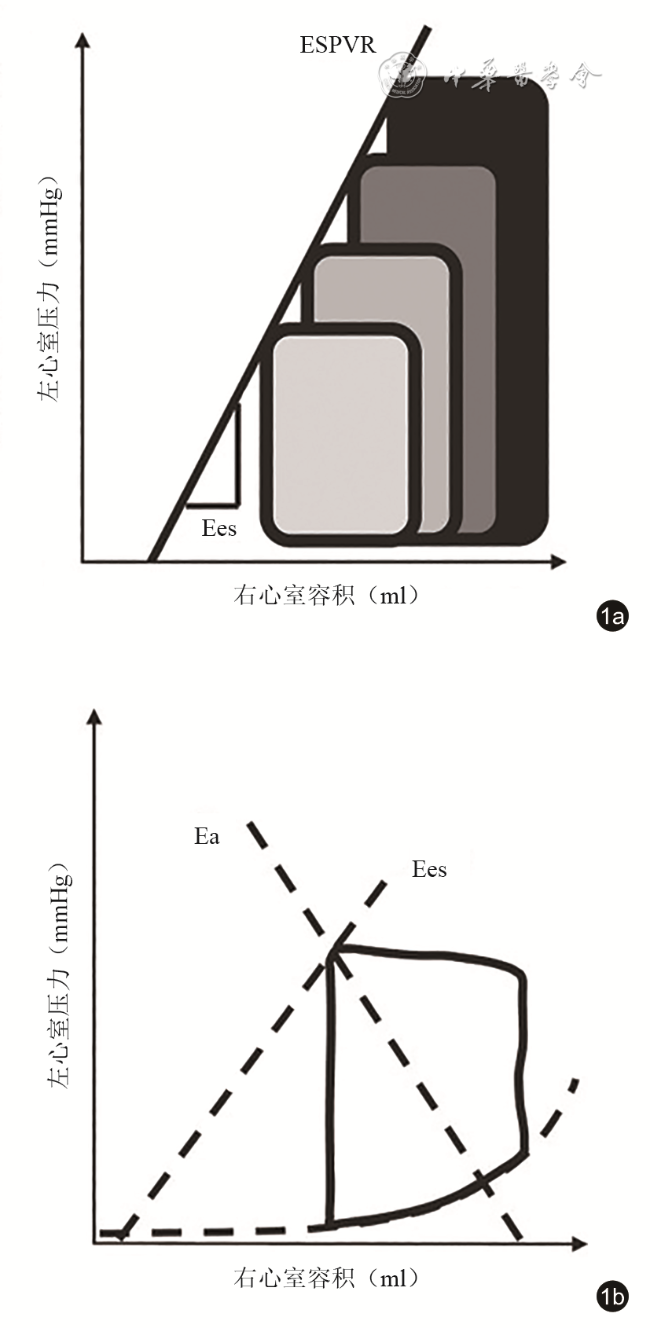
图1 右心室-肺动脉耦联的心导管评估方法。图a显示改变右心室前负荷后所得到的不同前负荷条件下的压力-容积曲线,每条曲线的收缩末期点形成右心室收缩末期压力容积关系线(ESPVR),其斜率即代表收缩末期弹性(Ees);图b显示在不改变前负荷的条件下,单个心动周期的压力-容积曲线(图中黑色闭环实线)中收缩末期点与舒张末期点连接形成的直线的斜率即有效动脉弹性(Ea),此时两条直线交汇点(Ees/Ea)即表征右心室-肺动脉耦联[图片改自:Ikonomidis I, Aboyans V, Blacher J, et al. The role of ventricular-arterial coupling in cardiac disease and heart failure: assessment, clinical implications and therapeutic interventions. A consensus document of the European Society of Cardiology Working Group on Aorta & Peripheral Vascular Diseases, European Association of Cardiovascular Imaging, and Heart Failure Association. Eur J Heart Fail, 2019, 21(4): 402-424.]注:1 mmHg=0.133 kPa |