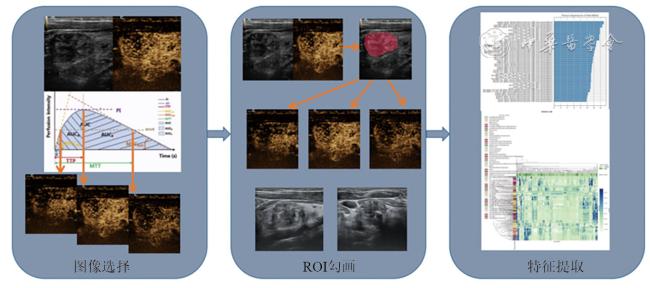
资料与方法
一、对象
二、仪器与方法
三、统计学分析
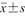 表示,采用t检验比较良恶性结节组间差异;结节最大径为不符合正态分布的计量资料,采用M(QR)表示,采用Mann-Whitney U检验比较2组间差异;余资料均为计数资料,采用例数(%)表示,采用χ2检验和Fisher精确概率检验比较2组间差异。绘制受试者操作特征(receiver operating characteristic,ROC)曲线,评价3种超声诊断模型的诊断效能,通过曲线下面积(area under curve,AUC)、准确性、敏感度、特异度、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)和F1评分评估模型在结节分类中的效能,并计算敏感度、特异度、PPV、NPV的95%可信区间。以P<0.05为差异具有统计学意义。
表示,采用t检验比较良恶性结节组间差异;结节最大径为不符合正态分布的计量资料,采用M(QR)表示,采用Mann-Whitney U检验比较2组间差异;余资料均为计数资料,采用例数(%)表示,采用χ2检验和Fisher精确概率检验比较2组间差异。绘制受试者操作特征(receiver operating characteristic,ROC)曲线,评价3种超声诊断模型的诊断效能,通过曲线下面积(area under curve,AUC)、准确性、敏感度、特异度、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)和F1评分评估模型在结节分类中的效能,并计算敏感度、特异度、PPV、NPV的95%可信区间。以P<0.05为差异具有统计学意义。结果
一、患者一般信息与结节的超声特征
表1 不同超声组学模型对测试集甲状腺结节的诊断结果 |
| 诊断模型 | 病理结果 | |
|---|---|---|
| 良性 | 恶性 | |
| 灰阶超声 | ||
| 良性 | 11 | 2 |
| 恶性 | 5 | 20 |
| 灰阶超声+常规CEUS | ||
| 良性 | 11 | 1 |
| 恶性 | 5 | 21 |
| 灰阶超声+H-CEUS | ||
| 良性 | 14 | 3 |
| 恶性 | 2 | 19 |
注:CEUS为超声造影,H-CEUS为高帧频超声造影 |
表2 良恶性甲状腺结节组一般临床资料及影像特征比较 |
| 项目 | 恶性结节组(n=108) | 良性结节组(n=78) | 统计值 | P值 |
|---|---|---|---|---|
年龄(岁,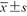 ) ) | 43.06±11.51 | 46.54±12.30 | t=1.973 | 0.050 |
| 性别[例(%)] | χ2=2.905 | 0.088 | ||
| 男 | 21(19.44) | 8(10.26) | ||
| 女 | 87(80.56) | 70(89.74) | ||
| 结节最大径[mm,M(QR)] | 7.0(5.0,10.0) | 12.5(9.0,26.0) | Z=6.076 | <0.001 |
| 结节内部成分[例(%)] | ||||
| 实性 | 108(100) | 69(88.46) | - | <0.001 |
| 非实性 | 0(0) | 9(11.54) | ||
| 纵横比[例(%)] | χ2=22.965 | <0.001 | ||
| ≥1 | 44(40.74) | 7(8.97) | ||
| <1 | 64(59.26) | 71(91.03) | ||
| 内部钙化[例(%)] | χ2=5.454 | 0.020 | ||
| 有微钙化 | 36(33.33) | 14(17.95) | ||
| 无微钙化 | 72(66.67) | 64(82.05) | ||
| 灌注强度[例(%)] | χ2=17.330 | <0.001 | ||
| 高灌注 | 9(8.33) | 25(32.05) | ||
| 等灌注 | 33(30.56) | 20(25.64) | ||
| 低灌注 | 66(61.11) | 33(42.31) | ||
| 灌注模式[例(%)] | χ2=9.033 | 0.003 | ||
| 不均匀 | 48(44.44) | 18(23.08) | ||
| 均匀 | 60(55.56) | 60(76.92) | ||
| 灌注方式[例(%)] | χ2=21.099 | <0.001 | ||
| 向心性 | 38(35.19) | 5(6.41) | ||
| 非向心性 | 70(64.81) | 73(93.59) | ||
| TI-RADS分级[例(%)] | - | <0.001 | ||
| 3级 | 0(0) | 5(6.41) | ||
| 4a级 | 28(25.93) | 50(64.10) | ||
| 4b级 | 41(37.96) | 19(24.36) | ||
| 4c级 | 39(36.11) | 4(5.13) |
注:TI-RADS为甲状腺影像报告与数据系统,-表示采用Fisher确切概率法,无相应统计值 |
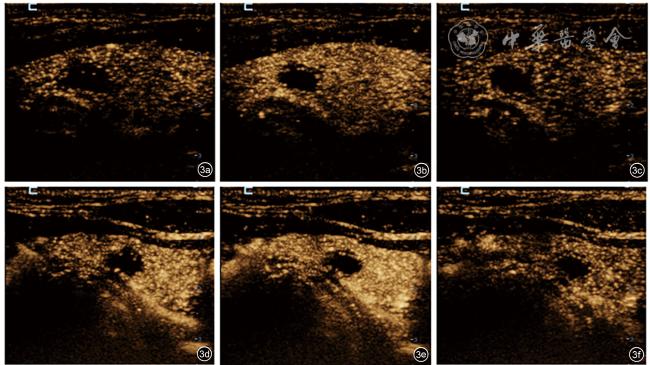
图2 恶性结节常规超声造影图像及高帧频超声造影(H-CEUS)图像。该结节细针穿刺病理结果为“Bethesda Ⅵ”,甲状腺乳头状癌;图a为常规超声造影到达时刻图像;图b为常规超声造影达峰时刻图像;图c为常规超声造影平均消退时刻图像;图d为H-CEUS到达时刻图像;图e为H-CEUS达峰时刻图像;图f为H-CEUS平均消退时刻图像。本图中常规超声造影帧频为15帧/s,H-CEUS帧频为87帧/s |
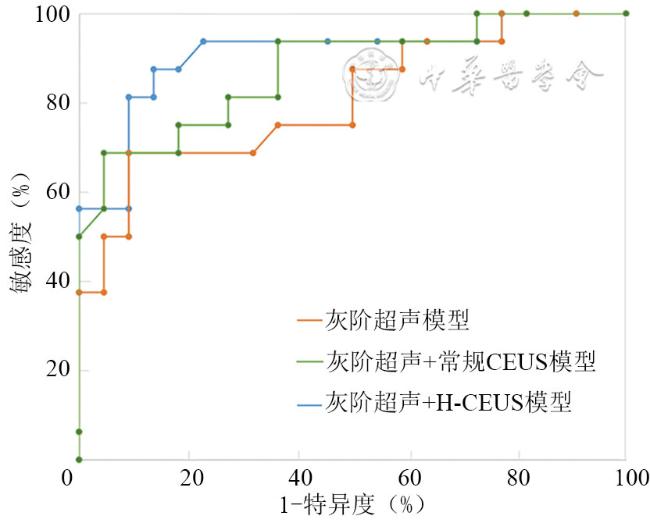
二、影像组学特征及模型效能评估
表3 3种诊断模型对测试集中甲状腺结节良恶性的诊断效能 |
| 诊断模型 | 准确性(%) | 敏感度(%) | 特异度(%) | PPV(%) | NPV(%) | F1评分 |
|---|---|---|---|---|---|---|
| 灰阶超声 | 81.6 | 68.8(44.4~85.8) | 90.9(72.2~97.5) | 84.6(57.8~95.7) | 80.0(60.9~91.1) | 0.76 |
| 灰阶超声+常规CEUS | 84.2 | 68.8(44.4~85.8) | 95.5(78.2~99.2) | 91.7(64.6~98.5) | 80.8(62.1~91.5) | 0.79 |
| 灰阶超声+H-CEUS | 86.8 | 87.5(64.0~96.5) | 86.4(0.66.7~95.3) | 82.4(59.0~93.8) | 90.5(71.1~97.4) | 0.85 |
注:CEUS为超声造影,H-CEUS为高帧频超声造影,PPV为阳性预测值,NPV为阴性预测值;括号内数据为相应指标的95%可信区间 |