资料与方法
一、对象
二、仪器与方法
三、统计学分析
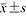 表示。采用独立样本t检验比较DMD组与健康儿童组2组数据的组间差异,同一组内吸气末Tdi与呼气末Tdi比较采用配对t检验。以P<0.05为差异有统计学意义
表示。采用独立样本t检验比较DMD组与健康儿童组2组数据的组间差异,同一组内吸气末Tdi与呼气末Tdi比较采用配对t检验。以P<0.05为差异有统计学意义结果
一、一般资料
(一)临床表现
(二)病理组织检查和实验室检查结果
二、超声表现
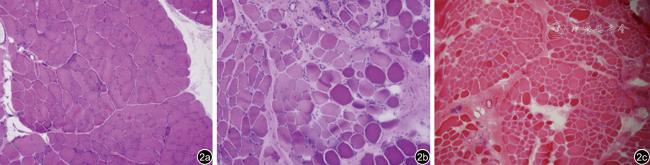
(一)二维超声表现
(二)M型超声表现
表1 DMD组、正常对照组膈肌吸气末厚度与呼气末厚度比较(mm, |
| 组别 | 例数 | 右侧腋前线 | t值 | P值 | 右侧锁骨中线 | t值 | P值 | ||
|---|---|---|---|---|---|---|---|---|---|
| 吸气末Tdi | 呼气末Tdi | 吸气末Tdi | 呼气末Tdi | ||||||
| DMD组 | 21 | 4.26±0.60 | 4.05±0.59 | 0.874 | 0.593 | 4.62±0.60 | 4.35±0.59 | 0.913 | 0.493 |
| 对照组 | 21 | 1.72±0.24 | 1.18±0.21 | 0.841 | 0.004 | 1.69±0.30 | 0.99±0.20 | 0.527 | 0.006 |
注:DMD为Duchenne肌营养不良;Tdi为膈肌厚度 |
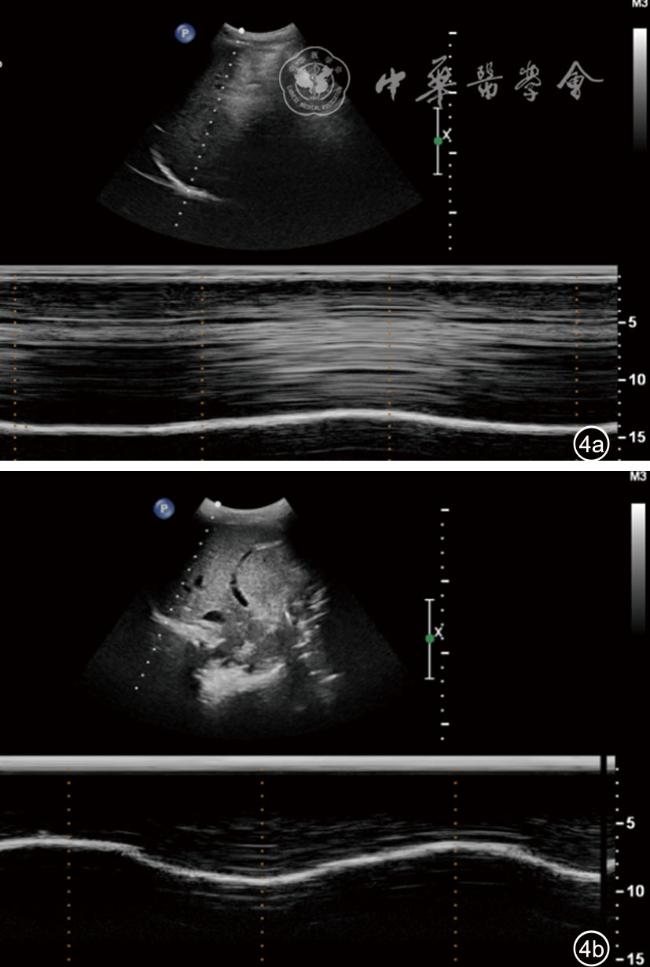
图4 右侧腋前线切面Duchenne肌营养不良患儿与正常儿童膈肌超声图像。图a示Duchenne肌营养不良患儿膈肌运动幅度随呼吸运动变化减弱,接近平直,吸气末与呼气末膈肌的厚度未见明显变化;图b示正常儿童膈肌随呼吸运动变化明显,呈“大波浪”样表现 |
表2 DMD组与正常对照组DE、DTF对比 |
| 组别 | 例数 | 右侧锁骨中线DTF(%) | 右侧腋前线DTF(%) | 右侧锁骨中线DE(mm) | 右侧腋前线DE(mm) |
|---|---|---|---|---|---|
| DMD组 | 21 | 32.9±19.0 | 38.3±19.4 | 11.7±4.1 | 12.0±5.0 |
| 对照组 | 21 | 49.7±11.5 | 50.6±10.9 | 20.0±5.3 | 19.0±3.3 |
| t值 | 0.079 | 0.013 | 0.603 | 0.207 | |
| P值 | 0.002 | 0.015 | <0.001 | <0.001 |
注:DMD为Duchenne肌营养不良;DTF为膈肌增厚率;DE为膈肌移动度 |


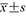 )
)