肿瘤的发生发展严重影响患者的生活质量及生存时间。目前,放化疗及免疫治疗仍是肿瘤治疗的主要手段
[1]。由于肿瘤血管的不成熟、不均衡生长,肿瘤内部易形成乏血供区域
[2]。肿瘤内部组织间压升高致使肿瘤血管塌陷,进一步导致肿瘤乏氧状态的形成
[3]。肿瘤区域乏血供乏氧微环境导致肿瘤多种治疗抵抗,化疗药物难以抵达肿瘤内部导致化疗抵抗,缺乏氧自由基导致放疗抵抗,T细胞浸润不足导致免疫治疗抵抗
[2]。因此,肿瘤乏血供乏氧微环境使实体肿瘤治疗面临挑战。
近年来,Belcik等
[4-5]以及Xie等
[6]的研究表明,超声激励微泡空化可以增加小鼠局部肌肉以及心肌的血流灌注并且改善组织缺血,这种效应被称为“Sonoreperfusion”。本课题组前期研究发现低强度诊断超声激励微泡空化可增加乏血供肿瘤的血流灌注,即超声肿瘤血流效应
[7-8],从而有望改善缺血及放化疗抵抗
[9,10,11]。而超声空化的强弱与许多参数有关,包括机械指数(mechanical index,MI)、脉冲重复频率(pulse repetition frequency,PRF)、占空比、治疗时间等。本课题组已经对其他超声参数进行了初步讨论,然而治疗时间仍依赖经验性选择。对于超声激励的空化治疗,宽泛的治疗时间选择会导致动物实验以及后期临床实践的不规范和随意性,可能会降低超声肿瘤血流效应的稳定性,并增加副作用的发生风险。因此,对于超声空化增强乏血供肿瘤血流灌注的治疗时间的研究是十分必要的。
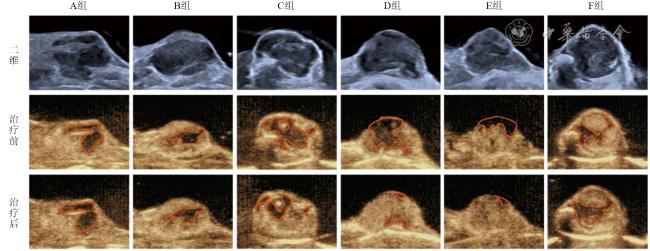
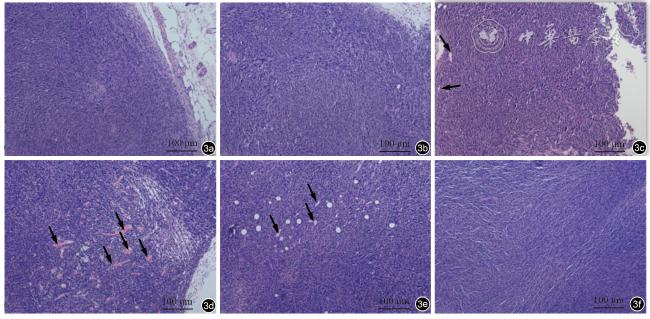
本实验通过建立小鼠皮下MC38肿瘤模型,研究在其他参数相同的条件下,不同超声治疗时间对诊断超声激励微泡空化增强肿瘤血流灌注的影响,旨在明确能够使肿瘤血流灌注增强的最佳治疗时间,探究超声肿瘤血流效应是否会随着治疗时间的延长而增强,并对治疗相关的机制进行初步探索。
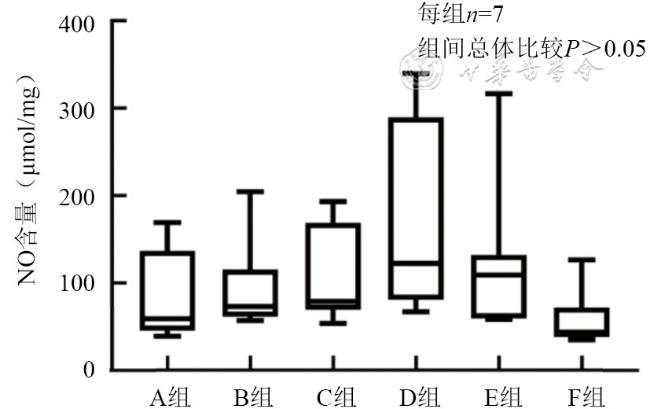
 表示,不符合正态分布的以M(P25,P75)表示。各组PI比、AUC比、灌注面积比的比较采用单因素方差分析,组间两两比较采用LSD法;各组一氧化氮含量比较采用Kruskal-Wallis H检验。以P<0.05为差异有统计学意义。
表示,不符合正态分布的以M(P25,P75)表示。各组PI比、AUC比、灌注面积比的比较采用单因素方差分析,组间两两比较采用LSD法;各组一氧化氮含量比较采用Kruskal-Wallis H检验。以P<0.05为差异有统计学意义。
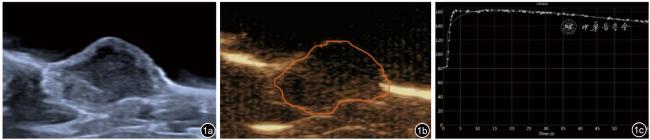
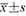 ,每组n=9)
,每组n=9)