资料与方法
一、对象
二、仪器与方法
三、统计学分析
结 果
一、一般特征
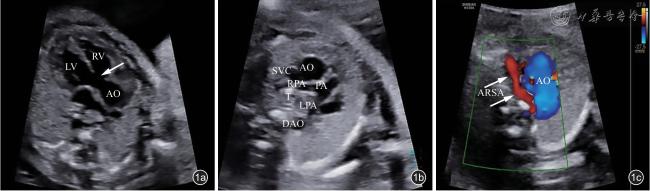
二、超声特征
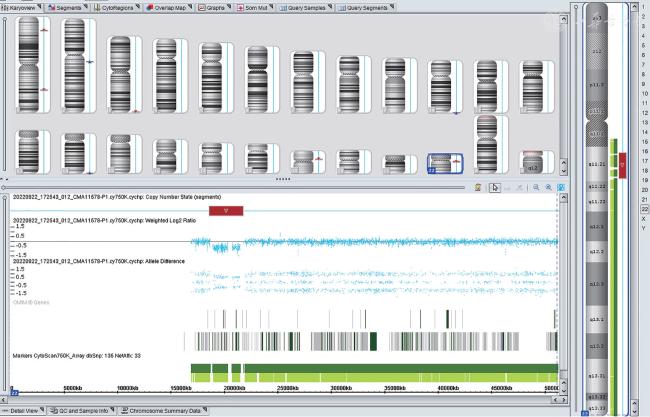
三、基因遗传学检测结果
表1 22q11.2 微缺失综合征病例资料统计表 |
| 序号 | 孕周(周) | 临床指征 | 胎儿性别 | 遗传学检测结果 | 异常区带 | 超声表现 | 结局 |
|---|---|---|---|---|---|---|---|
| 1 | 24+6 | 超声异常 | 女 | 胎儿染色体22q11.21区域存在3.169Mb的DNA片段缺失。ClinGen数据库提示该片段包含22q11.2recurrent(DGS/VCFS)region(proximal,A-D)(includesTBX1)(chr22:18,912,231-21,465,672),具有明确单倍剂量致病效应(Haploinsuきciencyscore:3) | arr[hg19]22q11.21(18,631,364-21,800,471)x1 | 心轴左偏、膜周部室间隔缺损,肺动脉轻度狭窄,胸腺发育不良 | 终止妊娠 |
| 2 | 20 | 父母一方染色体异常携带 | 男 | 胎儿染色体22q11.21区域存在3.152Mb的片段缺失,涉及46个OMIM基因。Clingen数据库提示该缺失包含22q11.2recurrent(DGS/VCFS)region(proximal,A-D)(includesTBX1)(chr22:18,912,231-21,465,672),具有明确单倍剂量致病效应(Haploinsufficiencyscore:3),且>90%的缺失为新发变异 | arr[hg19]22q11.21(18,648,855-21,800,471)x1 | 室间隔缺损、主动脉骑跨、肺动脉狭窄、永存左上腔 | 终止妊娠 |
| 3 | 21+2 | 产前筛查高风险超声异常 | 男 | 胎儿染色体22q11.21区域存在3.152Mb的片段缺失。ClinGen数据库提示该片段包含22q11.2recurrent(DGS/VCFS)region(proximal,A-D)(includesTBX1)(chr22:18,912,231-21,465,672)(Haploinsufficiencyscore:3),且>90%的缺失为新发变异 | arr[hg19]22q11.21(18,648,855-21,800,471)x1 | 右心室双出口、室间隔缺损(主动脉瓣下型)、肺动脉狭窄瓣 | 终止妊娠 |
| 4 | 19 | 超声异常 | 男 | 胎儿染色体22q11.21区域存在3.152Mb的片段缺失。ClinGen数据库提示该片段覆盖22q11.2recurrent(DGS/VCFS)region(proximal,A-D)(includesTBX1)(chr22:18,912,231-21,465,672)(Haploinsufficiencyscore:3),且>90%的缺失为新发变异。 | arr[hg19]22q11.21(18,648,855-21,800,471)x1 | 胸腺发育不良 | 终止妊娠 |
| 5 | 21 | 产前筛查高风险 | 男 | 胎儿染色体22q11.21区域存在3.152Mb的DNA片段重复,位于22q11微重复综合征致病区域,包含转录因子TBX1等重要基因。ClinGen数据库提示22q11.2recurrent(DGS/VCFS)region(proximal,A-D)(includesTBX1)(chr22:18,912,231-21,465,672)具有明确三倍剂量致病效应(Triplosensitivityscore:3) | arr[hg19]22q11.21(18,648,855-21,800,471)x3 | 正常 | 正常分娩 |
| 6 | 19+6 | NIPT异常 | 男 | 胎儿染色体22q11.21区域存在3.152Mb的DNA片段重复,位于22q11微重复综合征致病区域,包含转录因子TBX1等重要基因。ClinGen数据库提示22q11.2recurrent(DGS/VCFS)region(proximal,A-D)(includesTBX1)(chr22:18,912,231-21,465,672)具有明确三倍剂量致病效应(Triplosensitivityscore:3) | arr[hg19]22q11.21(18,648,855-21,800,471)x3 | 正常 | 正常分娩 |
| 7 | 19+1 | 高龄/不良孕产史 | 女 | 胎儿染色体22q11.21区域存在1.084Mb的DNA片段缺失,涉及16个OMIM基因。ClinGen数据库提示该缺失包含22q11.2recurrentregion(central,B/C-D,chr22:20,731,986-21,465,672)(includesCRKL)区域 | arr[hg19]22q11.21(20,716,876-21,800,471)x1 | 胎儿室间隔缺损,肺动脉轻度狭窄,主动脉骑跨,胸腺偏小 | 终止妊娠 |
| 8 | 20+4 | NIPT异常/不良孕产史 | 男 | 胎儿染色体22q11.21区域存在1.084Mb的片段缺失。ClinGen数据库提示该缺失片段包含22q11.2recurrentregion(central,B/C-D)(includesCRKL)(chr22:20,731,986-21,465,672),鉴于临床表型多变、不完全外显、缺乏病例-对照数据,目前单倍剂量致病效应评分为2(Haploinsufficiencyscore:2) | arr[hg19]22q11.21(20,716,876-21,800,471)x1 | 胎儿正常 | 正常分娩 |
| 9 | 19+2 | NIPT异常 | 男 | 胎儿染色体22q11.21区域存在2.881Mb的片段缺失。ClinGen数据库提示该片段基本覆盖22q11.2recurrent(DGS/VCFS)region(proximal,A-D)(includesTBX1)(chr22:18,912,231-21,465,672)(Haploinsufficiencyscore:3),且>90%的缺失为新发变异 | arr[hg19]22q11.21(18,919,477-21,800,471)x1 | 右位主动脉弓,左锁骨下动脉迷走,心轴左偏73度,局限性心包积液,动脉导管走行迂曲 | 终止妊娠 |
| 10 | 26+6 | 超声异常 | 男 | 胎儿染色体22q11.21存在2.888Mb的片段缺失,含有42个OMIM基因,包含22q11.2recurrent(DGS/VCFS)region(proximal,A-D)(includesTBX1)(chr22:18,912,231-21,465,672)关键区域,Clingen提示单倍剂量致病明确 | arr[hg19]22q11.21chr22:18,912,231-21,465,672) | 胎儿室间隔缺,主动脉发育不良,主动脉弓离断(B型) | 终止妊娠 |
| 11 | 26+4 | 遗传 | 女 | 胎儿染色体22q11.21区域存在1.07Mb的DNA片段缺失,涉及14个OMIM基因。ClinGen数据库提示该缺失包含22q11.2recurrentregion(central,B/C-D,chr22:20,731,986-21,465,672)(includesCRKL)区域 | arr[hg19]22q11.21(20,730,143-21,800,471)x1 | 胎儿左肾多囊肾、胎儿右肾盆腔肾、右下肢偏短 | 终止妊娠 |
| 12 | 22+6 | 超声异常 | 男 | 胎儿染色体22q11.21存在1.664Mb的片段缺失,涉及29个OMIM基因。Clingen数据库提示该片段缺失包含22q11.2recurrent(DGS/VCFS)region(proximal,A-B)(includesTBX1)(chr22:18,912,231-20,287,208),具有明确单倍剂量致病效应(Haploinsufficiencyscore:3)。 | arr[hg19]22q11.21(18,648,855-20,312,661)x1 | 室间隔缺损型肺动脉闭锁、右位主动脉弓、心轴左偏 | 终止妊娠 |