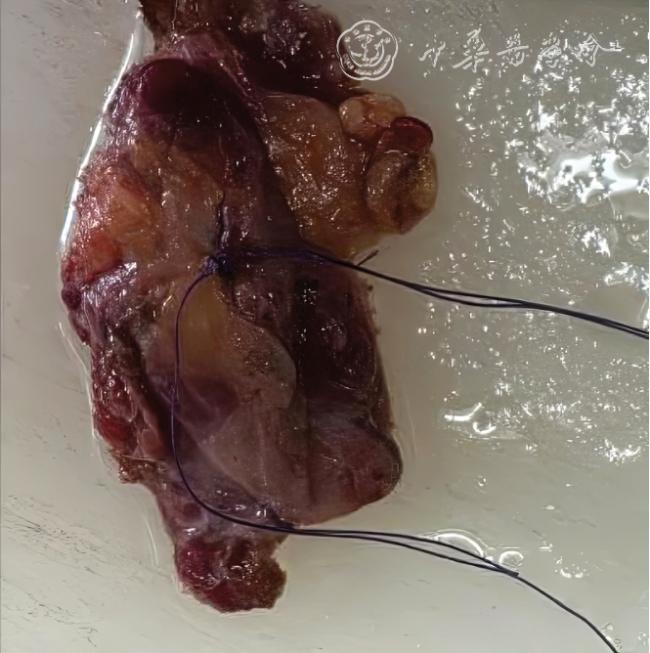
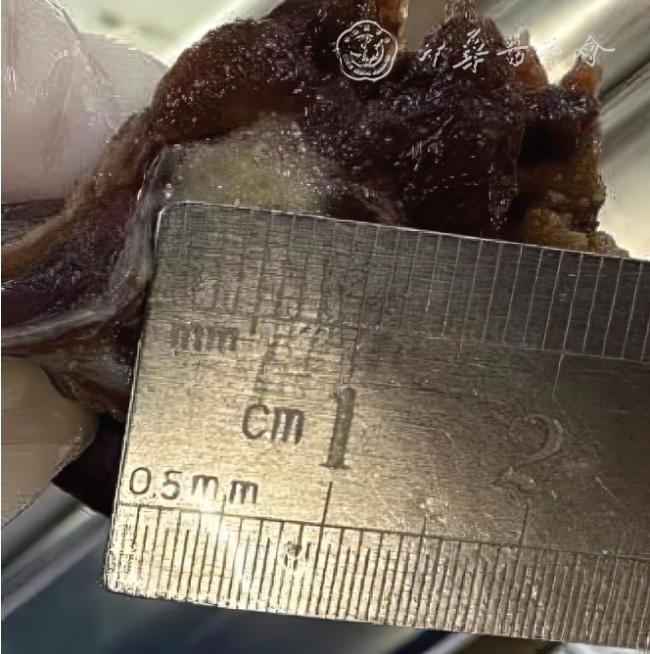
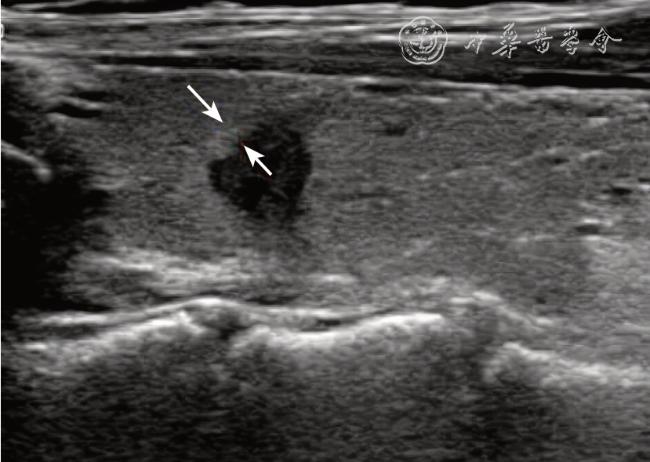
既往国内外学者通过大量研究发现,甲状腺肿瘤大小的术前超声影像评估与手术后大体组织的病理测量结果存在差异
[12,13,14,15]。Deveci 等
[12]最早进行报道,术前超声和术后病理测量的大小差异有统计学意义,病灶<10 mm 的吻合率仅为78.5%。韩国学者Yoon 等
[14]针对PTC 的研究表明,以术后病理标本测量结果为标准,超声普遍存在高估,多数PTC 术后病理标本测量的大小在术前超声评估数值的90%以下。王颖等
[16]对122 个PTC 癌灶进行超声影像测量和术后大体标本测量的对比研究结果显示,超声最大径显著高于病理最大径,差异有统计学意义。与既往研究只测量一个最大径线不同,本研究采用2 个径线(上下径和左右径),使测量角度二维化,并且通过缝线标记的方式使超声和病理尽量在相同的方位上测量得到最大径。因进行常规病理检查需要制作石蜡切片,将病灶切成数个厚度为4 ~6 μm 的薄片,这一操作是在标本或者腺体的厚度方向(前后径)上切割,故本研究未纳入前后径这一径线资料。69 个病灶中,上下径或(和)左右径超声影像比大体标本测值偏大者占81.2%(56/69),与既往研究结果相近
[12,13,16]。文献报道产生超声影像高估的原因是多方面的;首先是超声成像原理导致的误差,Deveci 等
[12]认为与超声波在颈部不同软组织间的传播速度差异有关,尤其存在病灶不规则、边界模糊等情况时容易导致测量误差;探头发射频率不同也会导致图像细微结构的差异,从而影响对肿瘤边界的判定,本研究所有图像采集均使用同一超声仪器的同一线阵探头,并使用预设模式进行微调,力求将误差降到最低。Yoon 等
[14]指出超声检查时探头压迫甲状腺的动作可能增加了超声影像下肿瘤的测量结果;另外,超声检查的医师依赖性强,其加压力度及对图像的判读均有不同,但经验丰富的超声医师之间一致性较好,准确率可达82.8%
[17],因此,本研究中图像采集的超声医师均为从事甲状腺专项检查5 年以上的高年资医师,并统一采集标准。其次是病灶离体后的生理性变化,外科切除的标本由于离体后血供消失和组织液外溢,在一定程度上会产生固缩,采用4%甲醛溶液浸泡导致肿瘤和边缘尺寸缩小,会使大体标本测值偏小
[18]。再者因大体标本是由病理医师通过触摸病灶盲切产生病灶剖面,肉眼观察病灶范围并使用毫米级标尺进行测量,误差偏大。