Objective
To establish a radiomics model based on ultrasound image analysis of the rectus femoris muscle, and to assess its diagnostic value for sarcopenia in elderly individuals.
Methods
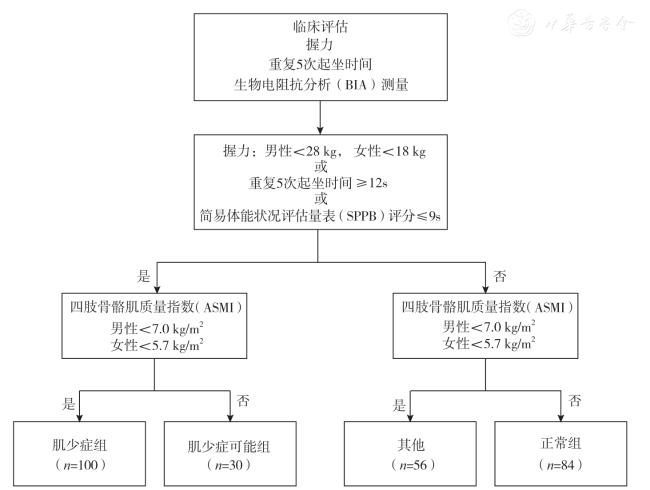
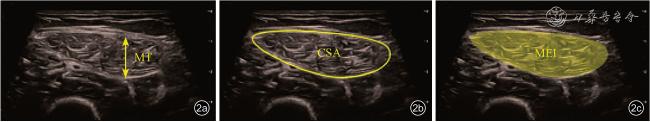
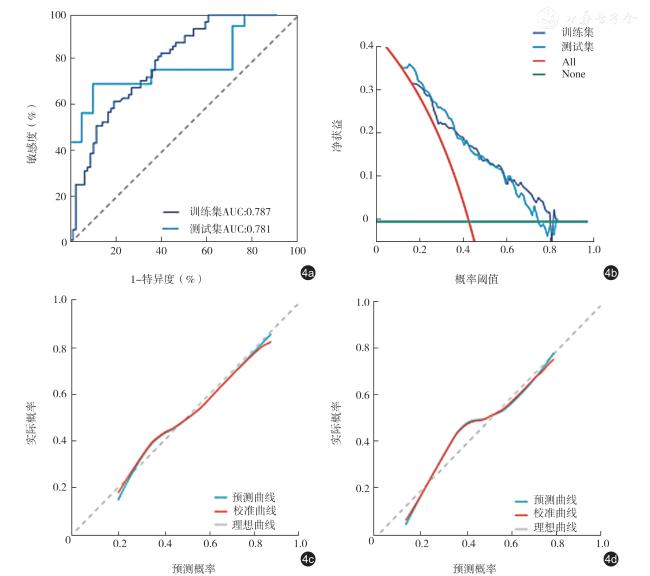
Elderly participants were recruited from the Department of Gerontology, Peking Union Medical College Hospital from July 2021 to April 2024.After a detailed grouping process based on the diagnostic criteria of the Asian Working Group for Sarcopenia 2019 (AWGS 2019), a total of 100 participants with sarcopenia and 84 normal participants were included.In terms of clinical assessment, height, weight, and body mass index (BMI) were measured for all participants.Bioelectrical impedance analysis was also conducted to measure trunk muscle mass and limb muscle mass, based on which appendicular skeletal muscle mass index (ASMI) was calculated.For ultrasound measurements, muscle thickness (MT), cross-sectional area (CSA), and muscle echogenicity intensity (MEI) at the midpoint of the rectus femoris muscle were measured in B-mode.The Spearman correlation test was used to analyze the correlation between ultrasound measurement indicators and clinical indicators.In terms of radiomics, the region of interest (ROI) delineated included the rectus femoris muscle within the imaging area.Radiomic feature extraction and analysis were performed for the ROI to establish a radiomic model.During the model training and testing process, the original data were randomly allocated to a training set and a test set in a 4:1 ratio.The accuracy of ultrasound indicators and the radiomic model in predicting sarcopenia was evaluated using the area under the receiver operating characteristic (ROC) curve (AUC) value, and a combined diagnostic model was established through multivariate logistic regression analysis, and the accuracy of the combined diagnostic model was evaluated by ROC curve.
Results
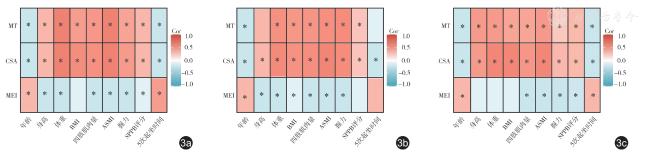
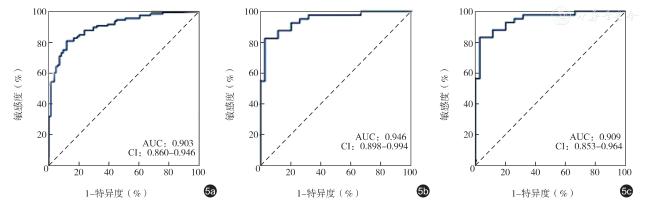
Statistically significant differences were observed in various ultrasoundmeasured indicators between the two groups (P<0.05 for all).MT (r=0.587, P<0.001) and CSA (r=0.640,P <0.001) showed a positive correlation with ASMI, while MEI demonstrated a negative correlation with ASMI (r=-0.358, P<0.001).The diagnostic performance of CSA (AUC=0.795 for all participants,AUC=0.804 for males, and AUC=0.800 for females) was superior to that of MT and MEI.The AUC values of the radiomics model established in this study for the diagnosis of sarcopenia were 0.787 and 0.781 in the training set and test set, respectively.A combined diagnostic model was developed through multivariate logistic regression analysis, incorporating factors such as age, BMI, and evaluation results of the radiomics model.This combined model exhibited high accuracy in diagnosing sarcopenia, with AUC values of 0.903 for all participants, 0.946 for males, and 0.909 for females.
Conclusion
MT and CSA of the rectus femoris measured by ultrasound, as well as the ultrasound-based radiomics model, each possess good independent diagnostic value for sarcopenia.The combined diagnostic model exhibits high accuracy in diagnosing sarcopenia, offering a new and effective assessment method for sarcopenia diagnosis.
 ±s 描述,组间比较采用t 检验;四肢肌肉量、ASMI、握力、SPPB 评分和5 次起坐时间为不满足正态分布的计量资料,以M(QR)描述,组间差异比较采用Wilcoxon 秩和检验。采用Spearman 相关性检验分析超声测量指标与临床指标的相关性。采用ROC 曲线下面积(area under curve,AUC)值分别评估各项超声测量指标对肌少症的诊断效能,并计算敏感度和特异度。由于男性和女性肌少症的诊断标准存在差异,本研究分别计算了各项指标在男性和女性人群中的诊断AUC 值及截断值。正常组和肌少症组参与者的分组标准包括握力、ASMI、5 次起坐时间、SPPB 评分等临床指标,将未参与该分组诊断流程的基础临床指标(性别、年龄、BMI)、超声测量指标(MT、CSA、MEI)和影像组学模型评价结果纳入Logistic 回归分析,筛选老年人肌少症的独立影响因素,并建立联合诊断模型。
±s 描述,组间比较采用t 检验;四肢肌肉量、ASMI、握力、SPPB 评分和5 次起坐时间为不满足正态分布的计量资料,以M(QR)描述,组间差异比较采用Wilcoxon 秩和检验。采用Spearman 相关性检验分析超声测量指标与临床指标的相关性。采用ROC 曲线下面积(area under curve,AUC)值分别评估各项超声测量指标对肌少症的诊断效能,并计算敏感度和特异度。由于男性和女性肌少症的诊断标准存在差异,本研究分别计算了各项指标在男性和女性人群中的诊断AUC 值及截断值。正常组和肌少症组参与者的分组标准包括握力、ASMI、5 次起坐时间、SPPB 评分等临床指标,将未参与该分组诊断流程的基础临床指标(性别、年龄、BMI)、超声测量指标(MT、CSA、MEI)和影像组学模型评价结果纳入Logistic 回归分析,筛选老年人肌少症的独立影响因素,并建立联合诊断模型。