资料与方法
一、对象
二、方法
三、统计学分析
结 果
一、临床病理特征及ABUS 图像特征
表1 Luminal B 型乳腺癌患者术后未复发组与复发组临床病理及ABUS 图像特征比较[例(%)] |
| 特征 | 总计(n=293) | 未复发(n=257) | 复发(n=36) | 统计值 | P值 |
|---|---|---|---|---|---|
| 年龄[ 岁,M ( Q1, Q3 )] | 47.0(42.0,54.0) | 48.0(42.0,54.5) | 45.5(39.25,51.0) | Z=-1.831 | 0.067 |
| 绝经情况 | χ 2=0. 855 | 0.355 | |||
| 未绝经 | 183(62.5) | 158(61.5) | 25(69.4) | ||
| 已绝经 | 110(37.5) | 99(38.5) | 11(30.6) | ||
| 手术方式 | χ 2=0.568 | 0.494 | |||
| 保乳术后 | 79(27.0) | 71(27.6) | 8(22.2) | ||
| 全切术后 | 214(73.0) | 186(72.4) | 28(77.8) | ||
| 新辅助化疗 | χ 2=1.379 | 0.240 | |||
| 是 | 128(43.7) | 109(42.4) | 19(52.8) | ||
| 否 | 165(56.3) | 148(57.6) | 17(47.2) | ||
| 化疗 | χ 2=0.700 | 0.403 | |||
| 是 | 133(45.4) | 119(46.3) | 14(38.9) | ||
| 否 | 160(54.6) | 138(53.7) | 22(61.1) | ||
| 放疗 | χ 2=0.006 | 0.938 | |||
| 是 | 96(32.8) | 84(32.7) | 12(33.3) | ||
| 否 | 197(67.2) | 173(67.3) | 24(66.7) | ||
| T 分期 | χ 2=4.754 | 0.093 | |||
| 1 | 174(59.4) | 158(61.5) | 16(44.4) | ||
| 2 | 112(38.2) | 94(36.6) | 18(50) | ||
| 3 | 7(2.4) | 5(1.9) | 2(5.6) | ||
| N 分期 | χ 2=9.294 | 0.021 | |||
| 0 | 153(52.2) | 142(55.3) | 11(30.6) | ||
| 1 | 81(27.6) | 68(26.5) | 13(36.1) | ||
| 2 | 43(14.7) | 35(13.6) | 8(22.2) | ||
| 3 | 16(5.5) | 12(4.7) | 4(11.1) | ||
| PR 表达 | χ 2=0.012 | 0.913 | |||
| 阴性 | 39(13.3) | 34(13.2) | 5(13.9) | ||
| 阳性 | 254(86.7) | 223(86.8) | 31(86.1) | ||
| HER2 表达 | χ 2=0.233 | 0.629 | |||
| 阴性 | 100(34.1) | 89(34.6) | 11(30.6) | ||
| 阳性 | 193(65.9) | 168(65.4) | 25(69.4) | ||
| Ki-67 表达 | χ 2=5.794 | 0.016 | |||
| < 30% | 176(60.1) | 161(62.6) | 15(41.7) | ||
| ≥ 30% | 117(39.9) | 96(37.4) | 21(58.3) | ||
| 组织学分级 | χ 2=18.159 | < 0.001 | |||
| Ⅰ / Ⅱ级 | 256(87.4) | 233(90.7) | 23(63.9) | ||
| Ⅲ级 | 37(12.6) | 24(9.3) | 13(36.1) | ||
| 肿瘤最大径 | χ 2=7.683 | 0.021 | |||
| ≤ 2.0 cm | 100(34.1) | 94(36.6) | 6(16.7) | ||
| 2.0 ~ 5.0 cm | 163(55.6) | 140(54.5) | 23(63.9) | ||
| ≥ 5.0 cm | 30(10.2) | 23(8.9) | 7(19.4) | ||
| 形状 | χ 2=3.308 | 0.069 | |||
| 不规则 | 282(96.2) | 249(96.9) | 32(88.9) | ||
| 规则 | 11(3.8) | 8(3.1) | 3(8.3) | ||
| 边缘 | χ 2=0.05 | 0.823 | |||
| 不光整 | 283(96.6) | 248(96.5) | 35(97.2) | ||
| 光整 | 10(3.4) | 9(3.5) | 1(2.8) | ||
| 内部回声 | χ 2=0.05 | 0.823 | |||
| 低回声 | 283(96.6) | 248(96.5) | 35(97.2) | ||
| 混合回声 | 10(3.4) | 9(3.5) | 1(2.8) | ||
| 后方回声 | χ 2=1.862 | 0.394 | |||
| 无改变 | 199(67.9) | 178(69.3) | 21(58.3) | ||
| 增强 | 72(24.6) | 61(23.7) | 11(30.6) | ||
| 衰减 | 22(7.5) | 18(7.0) | 4(11.1) | ||
| 钙化 | χ 2=24.74 | < 0.001 | |||
| 无 | 190(64.8) | 180(70.0) | 10(27.8) | ||
| 有 | 103(35.2) | 77(30.0) | 26(72.2) | ||
| 高回声晕 | χ 2=0.121 | 0.728 | |||
| 无 | 163(55.6) | 142(55.3) | 21(58.3) | ||
| 有 | 130(44.4) | 115(44.7 | 15(41.7) | ||
| 冠状面汇聚征 | χ 2=0.99 | 0.753 | |||
| 无 | 88(30.0) | 78(30.4) | 10(27.8) | ||
| 有 | 205(70.0) | 179(69.6) | 26(72.2) | ||
| 冠状面跳跃征 | χ 2=14.905 | < 0.001 | |||
| 无 | 228(77.8) | 209(81.3) | 19(52.8) | ||
| 有 | 65(22.2) | 48(18.7) | 17(47.2) |
注:ABUS 为自动乳腺超声;PR 为孕激素受体;HER2 为人表皮生长因子受体2 |
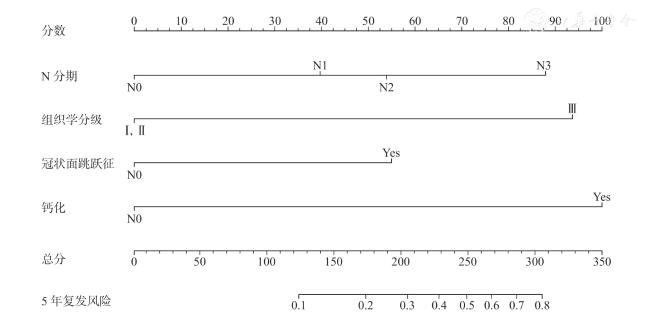
二、Luminal B 型乳腺癌患者复发风险的多因素Cox 回归分析
表2 Luminal B 型乳腺癌患者术后复发的多因素Cox 回归分析 |
| 因素 | β值 | SE | Wald χ2值 | HR (95% CI ) | P值 |
|---|---|---|---|---|---|
| N 分期 | |||||
| 0 | Ref | ||||
| 1 | 0.597 | 0.417 | 2.047 | 1.817( 0.802 ~ 4.117) | 0.153 |
| 2 | 0.853 | 0.491 | 3.011 | 2.346( 0.895 ~ 6.147) | 0.083 |
| 3 | 1.325 | 0.606 | 4.779 | 3.762( 1.147 ~ 12.337) | 0.029 |
| Ki-67 表达 | |||||
| < 30% | Ref | ||||
| ≥ 30% | 0.490 | 0.368 | 1.772 | 1.632(0.793 ~ 3.358) | 0.183 |
| 组织学分级 | |||||
| Ⅰ / Ⅱ级 | Ref | ||||
| Ⅲ级 | 1.269 | 0.398 | 10.178 | 3.558( 1.631 ~ 7.759) | 0.001 |
| 肿瘤最大径 | |||||
| ≤ 2.0 cm | Ref | ||||
| 2.0 ~ 5.0 cm | 0.263 | 0.479 | 0.302 | 1.301( 0.509 ~ 3.327) | 0.583 |
| ≥ 5.0 cm | 0.299 | 0.616 | 0.236 | 1.349(0.403 ~ 4.509) | 0.627 |
| 钙化 | |||||
| 无 | Ref | ||||
| 有 | 1.403 | 0.391 | 12.835 | 4.066( 1.888 ~ 8.757) | <0.001 |
| 冠状面跳跃征 | |||||
| 无 | Ref | ||||
| 有 | 0.779 | 0.366 | 4.534 | 2.178(1.064 ~ 4.460) | 0.033 |
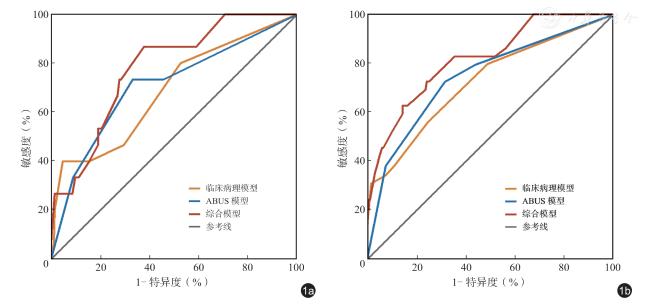
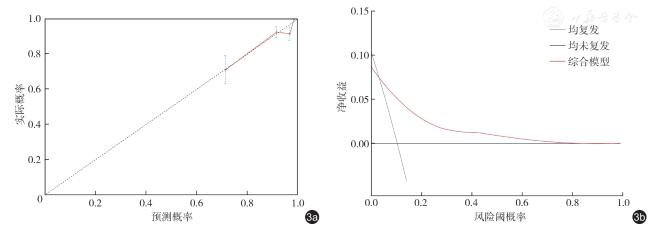
三、预测模型建立与验证
表3 Luminal B 型乳腺癌术后复发的3 种预测模型效能分析 |
| 模型 | C-index(95%CI) | 准确性(95%CI) | 敏感度(95%CI) | 特异度(95%CI) |
|---|---|---|---|---|
| 临床病理模型 | 0.687(0.593 ~ 0.781) | 0.717(0.669 ~ 0.768) | 0.583(0.425 ~ 0.744) | 0.735(0.683 ~ 0.788) |
| ABUS 模型 | 0.734(0.650 ~ 0.818) | 0.611(0.560 ~ 0.669) | 0.833(0.708 ~ 0.943) | 0.580(0.521 ~ 0.640) |
| 综合模型 | 0.791(0.718 ~ 0.864) | 0.816(0.766 ~ 0.858) | 0.856(0.813 ~ 0.899) | 0.810(0.747 ~ 0.864) |
注:ABUS 为自动乳腺超声;C-index 为一致性指数 |
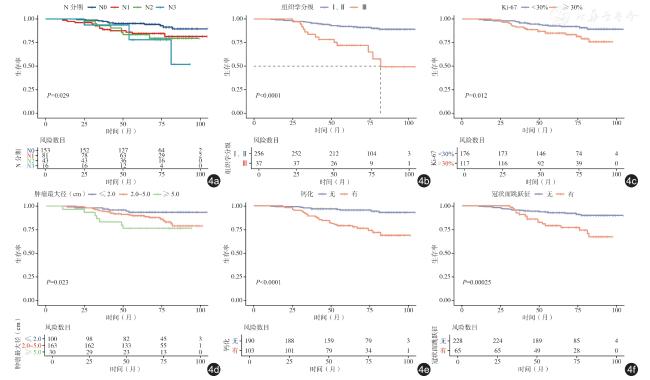
四、生存分析
图4 不同复发风险因素特征的Luminal B 型乳腺癌患者的术后生存曲线。图a 为不同N 分期患者的K-M 生存曲线;图b为不同组织学分级患者的K-M 生存曲线;图c 为Ki-67 高表达与Ki-67 低表达患者的K-M 生存曲线;图d 为不同肿瘤最大径患者的K-M 生存曲线;图e 为存在与不存在钙化患者的K-M 生存曲线;图f 为存在与不存在冠状面跳跃征患者的K-M生存曲线 |
表4 Luminal B 型乳腺癌患者生存分析 |
| 风险因素 | 例数 | 中位生存时间(月) | 累积生存率 | χ 2值 | P值 | |
|---|---|---|---|---|---|---|
| 3 年 | 5 年 | |||||
| N 分期 | 9.013 | 0.029 | ||||
| 0 | 153 | 71.00 | 95% | 94% | ||
| 1 | 81 | 64.00 | 88% | 85% | ||
| 2 | 43 | 67.00 | 91% | 79% | ||
| 3 | 16 | 56.50 | 94% | 77% | ||
| 组织学分级 | 23.713 | < 0.001 | ||||
| Ⅰ / Ⅱ级 | 256 | 70.00 | 94% | 91% | ||
| Ⅲ级 | 37 | 56.00 | 78% | 71% | ||
| Ki-67 | 6.355 | 0.012 | ||||
| 低表达 | 176 | 70.00 | 95% | 92% | ||
| 高表达 | 117 | 65.00 | 89% | 83% | ||
| 肿瘤最大径 | 7.579 | 0.023 | ||||
| ≤ 2.0 cm | 100 | 72.00 | 96% | 93% | ||
| 2.0 ~ 5.0 cm | 163 | 66.00 | 92% | 88% | ||
| ≥ 5.0 cm | 30 | 69.00 | 83% | 76% | ||
| 钙化 | 24.668 | < 0.001 | ||||
| 无 | 190 | 69.50 | 97% | 96% | ||
| 有 | 103 | 65.00 | 84% | 76% | ||
| 冠状面跳跃征 | 13.397 | < 0.001 | ||||
| 无 | 228 | 69.00 | 94% | 92% | ||
| 有 | 65 | 65.00 | 86% | 77% | ||