

2023 , Vol. 20 >Issue 10: 1023 - 1028
DOI: https://doi.org/10.3877/cma.j.issn.1672-6448.2023.10.004
左心室辅助装置支持下单纯收缩期主动脉瓣反流的超声心动图特征
Copy editor: 汪荣
收稿日期: 2022-10-31
网络出版日期: 2024-01-08
基金资助
天津市自然科学基金重点项目(18JCZDJC36200)
国家重点研发计划课题(2017YFC0111005)
版权
Echocardioimagedata features of solo-systolic aortic regurgitation during left ventricular assist device support
Received date: 2022-10-31
Online published: 2024-01-08
Copyright
分析连续流左心室辅助装置(CF-LVAD)植入术后患者出现单纯收缩期主动脉瓣反流(SSAR)的超声心动图特征,探讨其机制及临床意义。
回顾性分析2019年3月至2022年6月在泰达国际心血管病医院植入CF-LVAD的4例SSAR患者的临床和超声影像学资料。所有患者在LVAD植入前均接受经胸超声心动图(TTE),植入术中和围术期接受经食管超声心动图(TEE),并在植入后定期进行TTE随访,测量和分析其主动脉根部直径以及主动脉瓣开放、反流持续时间和缩流宽度。
LVAD植入后,超声心动图显示左心室卸载导致的室间隔同向运动及二尖瓣环室间隔侧组织运动速度显著减低或反向。主动脉瓣环和主动脉窦直径均较术前增加。主动脉瓣呈持续性关闭或间歇性开放。主动脉瓣环伴随着心动周期呈现动态变化,收缩期扩张,舒张期回缩。4例患者出现微量至少量的SSAR。随访结果显示,3例SSAR为一过性或无显著变化,1例恶化为重度主动脉瓣关闭不全。
LVAD植入后SSAR是一种少见的、既往被忽视的血流动力学征象,与LVAD支持下左心室卸载及跨主动脉瓣逆压力梯度有关。SSAR可能是CF-LVAD特殊病理生理学导致的主动脉瓣早期可逆性病变的标志之一。
任书堂 , 刘晓程 , 张亚东 , 孙佳英 , 陈萍 , 周建华 , 龙进 , 黄云洲 . 左心室辅助装置支持下单纯收缩期主动脉瓣反流的超声心动图特征[J]. 中华医学超声杂志(电子版), 2023 , 20(10) : 1023 -1028 . DOI: 10.3877/cma.j.issn.1672-6448.2023.10.004
To analyze the echocardioimagedata features of solo-systolic aortic regurgitation (SSAR) after continuous flow (CF) left ventricular assist device (LVAD) implantation to approach its mechanisms and clinical significance.
We retrospectively identified four patients with SSAR after CF-LVAD implantation at TEDA International Cardiovascular Hospital from March 2019 to June 2022. Pre-operative transthoracic echocardiography (TTE), intra- and post-operative transesophageal echocardiography (TEE), and follow-up TTE were performed in all patients. The aortic root dimensions, aortic valvular opening, aortic regurgitation duration, and vena contracta (VC) width were measured and analyzed.
Post-implantation TTE revealed ventricular septal paradoxical motion due to the unloading of the left ventricle, whereas the septum slightly bowed towards the left ventricle during diastole. The systolic velocity of mitral annulus motion became significantly reduced or negative. The aortic valve consistently closed or intermittently opened. The diameter of the aortic annulus and aortic sinus slightly increased. The morphology of the aortic annulus changed throughout the cycles, with the AV annulus abnormally distorted and dilated during systole. SSAR occurred in four cases (16.7 %), graded as minimal or mild. Subsequent follow-up results showed that SSAR was transient or unchanged in three cases and was worsening in one case.
SSSAR post-LVAD implantation is a peculiar and previously neglected hemodynamic sign, which relates to left ventricular unloading and reversed transaortic pressure gradient resulting from LVAD support. SSAR may serve as s surrogate for early reversible aortic valve lesions owing to the special pathophysiology of CF-LVAD.
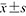 表示,非正态分布采用M(QR)表示。计数资料采用频数及构成比描述。
表示,非正态分布采用M(QR)表示。计数资料采用频数及构成比描述。图2 左心室辅助装置植入术后左心室及主动脉瓣环伴随着心动周期呈现不同程度的动态变化示意图。图a示舒张期胸骨旁左心室短轴切面,左心室短轴呈椭圆形,主动脉瓣环缩小;图b示收缩期胸骨旁左心室短轴切面,左心室恢复圆形,主动脉瓣环扩张;图c示舒张期心尖五腔心切面,室间隔左偏,主动脉瓣下移(蓝色箭头示心肌运动方向);图d示收缩期心尖五腔心切面,室间隔右偏,主动脉瓣上移(黄色箭头示心肌运动方向)注:AV为主动脉瓣;LV为左心室;AO为主动脉 |
表1 4例SSAR患者术前及术后的基本资料和主动脉瓣反流情况 |
| 序号 | 性别 | 年龄(岁) | BSA(m2) | BMI(kg/m2) | 泵速(r/min) | 术前AR | 术后首次发现SSAR | 随访期间AR | 末次随访状态 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 日期(d) | AV开放 | VC(mm) | 日期(d) | AV开放 | AR程度 | AR时相 | VC(mm) | ||||||||
| 1 | 男 | 62 | 1.89 | 25.6 | 2400 | 微量 | 14 | 1:2 | 2 | SSAR | 614 | 0 | 少 | 收缩期 | 2 |
| 2 | 男 | 53 | 2.10 | 28.3 | 2750 | 微量 | 1 | 0 | 1.5 | 转为双期 | 368* | 0* | 重* | 双期* | 6* |
| 3 | 女 | 55 | 1.68 | 25.9 | 2300 | 微量 | 0 | 0 | 1 | 消失 | 269 | 1:1 | 无 | - | - |
| 4 | 男 | 58 | 1.87 | 27.3 | 2450 | 0 | 0 | 0 | 1 | 转为双期 | 357 | 0 | 少 | 双期 | 2.5 |
注:BSA为体表面积;BMI体质量指数;AV为主动脉瓣;AR主动脉瓣反流;SSAR为单纯收缩期主动脉瓣反流;VC为主动脉瓣反流缩流径;*为重度主动脉瓣反流(后行经导管主动脉瓣植入术,此为术前末次检查结果) |
表2 4例SSAR患者的左心室结构、功能及主动脉根部超声参数 |
| 序号 | 术前 | 术后末次随访 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| LVEF(%) | LVEDD(mm) | LVESD(mm) | LVOT(mm) | AVA(mm) | AoS(mm) | LVEF(%) | LVEDD(mm) | LVESD(mm) | LVOT(mm) | AVA(mm) | AoS(mm) | |
| 1 | 28 | 77 | 72 | 22 | 21 | 29 | 31 | 74 | 71 | 24 | 22 | 32 |
| 2 | 19 | 93 | 89 | 28 | 26 | 34 | 29* | 90* | 86* | 27* | 27* | 35* |
| 3 | 29 | 65 | 60 | 20 | 20 | 26 | 68 | 46 | 33 | 24 | 20 | 26 |
| 4 | 17 | 91 | 87 | 20 | 19 | 27 | 22 | 92 | 85 | 25 | 21 | 27 |
注:LVEF为左心室射血分数;LVEDD为左心室舒张末期内径;LVESD为左心室收缩末期内径;LVOT为左心室流出道;AVA为主动脉瓣环直径;AoS为主动脉窦部直径;*为重度主动脉瓣反流(后行经导管主动脉瓣植入术,此为术前末次检查结果) |
| 1 |
|
| 2 |
|
| 3 |
施怡声, 朱振辉, 王浩, 等. 左室辅助装置植入前后主动脉瓣反流的超声评价和临床预后[J]. 中国胸心血管外科临床杂志, 2021, 28(6): 670-674.
|
| 4 |
任书堂, 刘晓程, 王正清, 等. 经食管超声心动图在左室辅助装置植入术中的应用价值 [J]. 中华超声影像学杂志, 2022, 31(9): 746-752.
|
| 5 |
|
| 6 |
|
| 7 |
|
| 8 |
尹立雪.主动脉瓣关闭不全的超声心动图量化评估及临床应用 [J/OL].中华医学超声杂志(电子版), 2021, 18(10): 921-925.
|
| 9 |
|
| 10 |
|
| 11 |
|
| 12 |
|
/
| 〈 |
|
〉 |