

2024 , Vol. 21 >Issue 04: 361 - 369
DOI: https://doi.org/10.3877/cma.j.issn.1672-6448.2024.04.003
自动乳腺超声联合免疫组化早期预测乳腺癌新辅助化疗病理完全缓解的临床价值
Copy editor: 汪荣
收稿日期: 2024-01-19
网络出版日期: 2024-06-13
基金资助
国家自然科学基金面上项目(82071934)
陕西省科技计划项目国合重点项目(2020KWZ-022)
陕西省高等教育教学改革研究重点项目(21JZ009)
空军军医大学临床研究项目(2021LC2210)
版权
Clinical value of automated breast ultrasound combined with immunohistochemistry in early prediction of pathological complete response to neoadjuvant chemotherapy in breast cancer
Received date: 2024-01-19
Online published: 2024-06-13
Copyright
探讨自动乳腺超声(ABUS)联合免疫组化早期预测乳腺癌患者新辅助化疗(NAC)后获得病理完全缓解(pCR)的临床价值。
收集2019年3月至2022年6月于空军军医大学第一附属医院(西京医院)乳腺外科收治的420例女性乳腺癌患者,所有患者均经穿刺病理证实为浸润性乳腺癌,患者在行NAC前均行ABUS检查,根据术后病理结果将乳腺癌患者分为pCR组153例和非病理完全缓解(npCR)组267例。采用多因素Logistic回归分析乳腺癌pCR的独立预测因素,构建3种预测模型分别为ABUS特征预测模型、免疫组化预测模型、ABUS联合免疫组化的联合预测模型。绘制3种模型的ROC曲线评估模型效能,通过DeLong检验比较模型的ROC曲线下面积,选择最优模型构建列线图。通过Hosmer-Lemeshow检验分析模型拟合度,采用Bootstrap法对模型进行内部验证,绘制校准度曲线对模型性能进行评估,使用决策曲线评估预测模型的临床获益。
乳腺癌NAC前pCR组与npCR组肿瘤的雌激素受体(ER)状态、孕激素受体(PR)状态、人表皮生长因子受体-2(HER-2)状态、Ki67状态和分子分型差异有统计学意义(P均<0.05);NAC前pCR组与npCR组肿瘤的皮肤侵犯、形态、后方回声、冠状面汇聚征、冠状面白墙征差异有统计学意义(P均<0.05)。多因素Logistic回归分析显示,HER-2状态(OR值:4.396, 95%CI:2.089~9.250)、分子分型(HER-2过表达型OR值:4.124,95%CI:2.069~8.219;三阴性型OR值:4.775,95%CI:2.188~10.422)、皮肤侵犯(OR值:0.110,95%CI:0.038~0.318)、冠状面汇聚征(OR值:0.416,95%CI:0.220~0.787)、冠状面白墙征(OR值:11.192,95%CI:5.316~23.561)是pCR的独立预测因子(P均<0.05)。DeLong检验表明基于ABUS模型和免疫组化特征构建的联合模型的ROC曲线下面积(AUC=0.855)显著高于免疫组化模型(AUC=0.758)和ABUS模型(AUC=0.774),差异均有统计学意义(Z=5.11,P<0.001;Z=5.49,P<0.001);ABUS模型的ROC曲线下面积(AUC=0.774)略高于免疫组化模型(AUC=0.758),但差异无统计学意义(Z=0.55,P=0.58)。Hosmer-Lemeshow检验表明联合模型拟合度良好(χ2=6.175,P=0.519);内部验证结果显示,C-指数为0.856(95%CI:0.810~0.886),表明模型稳定性良好;校准曲线表明联合模型的预测概率与实际概率一致性良好;决策曲线表明在广泛阈值范围内,联合模型具有较好的临床获益。
基于NAC前肿瘤的ABUS特征联合免疫组化构建联合模型可以早期准确预测乳腺癌NAC后pCR,可为乳腺癌患者临床治疗方案的制定提供依据。
赵阳 , 肖迎聪 , 巨艳 , 党晓智 , 蔡林利 , 薛文欣 , 李洋 , 肖瑶 , 郭妤绮 , 宋宏萍 . 自动乳腺超声联合免疫组化早期预测乳腺癌新辅助化疗病理完全缓解的临床价值[J]. 中华医学超声杂志(电子版), 2024 , 21(04) : 361 -369 . DOI: 10.3877/cma.j.issn.1672-6448.2024.04.003
To evaluate the clinical value of automated breast ultrasound (ABUS) combined with immunohistochemistry in early prediction of pathological complete response (pCR) to neoadjuvant chemotherapy (NAC) in breast cancer patients.
A total of 420 female breast cancer patients admitted to the Department of Breast Surgery, the First Affiliated Hospital of Air Force Military Medical University (Xijing Hospital) from March 2019 to June 2022 were included. All patients were confirmed to have invasive breast cancer by puncture pathology. All patients underwent ABUS examination before NAC. According to the postoperative pathological results, the patients were divided into either a pCR group (n=153) or a non-pathological complete response (npCR) group (n=267). Multivariate Logistic regression was used to identify the independent predictors of pCR in breast cancer. Three prediction models were constructed: ABUS feature prediction model, immunohistochemical prediction model, and ABUS combined with immunohistochemical prediction model. The receiver operating characteristic (ROC) curves of the three models were plotted to evaluate their performance. The area under the ROC curve (AUC) of the models was compared by the Delong test, and the optimal model was selected to construct a nomogram. The fitness of the model was analyzed by the Hosmer-Lemeshow test, and the Bootstrap method was used to verify the model internally. The calibration curve was drawn to evaluate the performance of the model, and the decision curve was used to evaluate the clinical benefit of the prediction model.
There were significant differences in estrogen receptor (ER) status, progesterone receptor (PR) status, human epidermal growth factor receptor (HER-2) status, Ki67 status, and molecular typing between the pCR group and npCR group before NAC (P<0.05 for all). There were also significant differences in skin invasion, morphology, posterior echo, retraction phenomenon on coronal images, and white wall sign on coronal images between the two groups before NAC (P<0.05 for all). Multivariate Logistic regression analysis showed that HER-2 status (odds ratio [OR]=4.396, 95% confidence interval [CI]: 2.089-9.25), molecular typing (HER-2 overexpression type: OR=4.124, 95%CI: 2.069-8.219; triple negative type (OR=4.775, 95%CI: 2.188-10.422), skin invasion (OR=0.110, 95%CI: 0.038-0.318), retraction phenomenon on coronal images (OR=0.416, 95%CI: 0.220-0.787), and white wall sign on coronal images (OR=11.192, 95%CI: 5.316-23.561) were independent predictors of pCR (P<0.05 for all). The Delong test showed that the AUC (0.855) of the combined model (nomogram) based on the ABUS model and immunohistochemical features was significantly higher than that of the immunohistochemical model (AUC=0.758; Z=5.11, P<0.001) and the ABUS model (AUC=0.774; Z=5.49, P<0.001); the AUC (0.774) of the ABUS model was slightly higher than that of the immunohistochemical model (AUC=0.758 ), but the difference was not statistically significant (Z=0.55, P=0.58). The Hosmer-Lemeshow test showed that the model fit well (χ2=6.175, P=0.519 ). The results of internal validation showed that the average C-index was 0.856 (95%CI: 0.810-0.886), indicating that the model had good stability. Calibration curve analysis showed that the prediction probability of the combined model was in good agreement with the actual probability. Decision curve analysis showed that the combined model had better clinical benefits in a wide range of thresholds.
The combined model based on ABUS features of pre-NAC tumors combined with immunohistochemistry can accurately predict pCR to NAC in breast cancer, which can provide a basis for the formulation of clinical treatment plans for breast cancer patients.
表1 npCR组与pCR组临床病理特征比较 [例(%)] |
| 临床病理特征 | npCR(n=267) | pCR(n=153) | 统计值 | P 值 |
|---|---|---|---|---|
年龄(岁,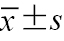 ) ) | 50.00(41.00,56.00) | 50.00(44.00,57.00) | Z=-0.669 | 0.503 |
| 绝经状态 | χ2=1.145 | 0.308 | ||
| 未绝经 | 154(57.6) | 80(52.3) | ||
| 已绝经 | 113(42.3) | 73(47.7) | ||
| ER状态 | χ2=59.287 | <0.001 | ||
| 阴性 | 69(25.8) | 98(64.1) | ||
| 阳性 | 198(74.2) | 55(35.9) | ||
| PR状态 | χ2=52.110 | <0.001 | ||
| 阴性 | 96(36.0) | 111(72.5) | ||
| 阳性 | 171(64.0) | 42(27.5) | ||
| HER-2状态 | χ2=32.646 | <0.001 | ||
| 阴性 | 168(62.9) | 52(34.0) | ||
| 阳性 | 99(37.1) | 101(66.0) | ||
| Ki67 状态 | χ2=10.228 | 0.002 | ||
| ≤14% | 42(15.7) | 8(5.3) | ||
| >14% | 225(84.3) | 145(94.7) | ||
| 分子分型 | χ2=82.056 | <0.001 | ||
| Luminal型 | 204(76.4) | 55(36.0) | ||
| HER-2过表达型 | 20(7.5) | 60(39.2) | ||
| 三阴性型 | 43(16.1) | 38(24.8) |
注:npCR为非病理完全缓解;pCR为病理完全缓解;ER为雌激素受体;PR为孕激素受体;HER-2为人表皮生长因子受体-2 |
表2 npCR组与pCR组ABUS特征比较[例(%)] |
| ABUS特征 | npCR(n=267) | pCR(n=153) | 统计值 | P值 |
|---|---|---|---|---|
| 肿瘤最长径[cm,M(P25,P75)] | 3.12(2.55,4.11) | 3.10(2.40,3.80) | Z=-0.890 | 0.374 |
| 皮肤侵犯 | χ2=14.281 | <0.001 | ||
| 否 | 218(81.6) | 145(94.7) | ||
| 是 | 49(18.4) | 8(5.3) | ||
| 形态 | χ2=7.425 | 0.013 | ||
| 不规则 | 261(97.8) | 141(92.2) | ||
| 规则 | 6(2.2) | 12(7.8) | ||
| 生长方向 | χ2=3.704 | 0.054 | ||
| 不平行 | 31(11.6) | 9(5.9) | ||
| 平行 | 236(88.4) | 144(94.1) | ||
| 内部回声 | χ2=0.003 | 0.955 | ||
| 低回声 | 258(96.6) | 148(96.7) | ||
| 混合回声 | 9(3.4) | 5(3.3) | ||
| 后方回声 | χ2=17.470 | <0.001 | ||
| 无改变 | 208(77.9) | 97(63.4) | ||
| 增强 | 33(12.4) | 44(28.8) | ||
| 衰减 | 26(9.7) | 12(7.8) | ||
| 钙化 | χ2=0.019 | 0.972 | ||
| 无 | 124(46.4) | 70(45.8) | ||
| 有 | 143(53.6) | 83(54.2) | ||
| 冠状面汇聚征 | χ2=28.331 | <0.001 | ||
| 无 | 167(62.5) | 133(86.9) | ||
| 有 | 100(37.4) | 20(13.1) | ||
| 冠状面跳跃征 | χ2=1.718 | 0.208 | ||
| 无 | 240(89.9) | 131(85.6) | ||
| 有 | 27(10.1) | 22(14.4) | ||
| 冠状面白墙征 | χ2=61.392 | <0.001 | ||
| 无 | 242(90.6) | 89(58.2) | ||
| 有 | 25(9.4) | 64(41.8) |
注:npCR为非病理完全缓解;pCR为病理完全缓解;ABUS为自动乳腺超声 |
表3 pCR独立预测因子的多因素Logistic回归分析 |
| 因素 | β值 | 标准误差 | Wald值 | P值 | OR值 | 95%CI |
|---|---|---|---|---|---|---|
| HER-2状态 | 1.481 | 0.380 | 15.219 | <0.001 | 4.396 | 2.089~9.250 |
| Luminal型 | 0 | |||||
| HER-2过表达型 | 1.417 | 0.352 | 16.215 | <0.001 | 4.124 | 2.069~8.219 |
| 三阴性型 | 1.563 | 0.398 | 15.411 | <0.001 | 4.775 | 2.188~10.422 |
| 皮肤侵犯 | -2.210 | 0.543 | 16.575 | <0.001 | 0.110 | 0.038~0.318 |
| 冠状面汇聚征 | -0.876 | 0.325 | 7.260 | 0.007 | 0.416 | 0.220~0.787 |
| 冠状面白墙征 | 2.415 | 0.380 | 40.436 | <0.001 | 11.192 | 5.316~23.561 |
| 常量 | -2.079 | 0.334 | 38.793 | <0.001 | 0.125 |
注:pCR为病理完全缓解;HER-2为人表皮生长因子受体-2 |
图2 基于自动乳腺超声和免疫组化特征的联合模型列线图。分子分型1、2、3分别代表Luminal型、HER-2过表达型、三阴性型;HER-2的0、1分别代表阴性、阳性;皮肤侵犯、冠状面汇聚征、冠状面白墙征的0、1分别代表无、有注:HER-2为人表皮生长因子受体-2;pCR为病理完全缓解 |
图5 患者,52岁,女性,浸润性乳腺癌(Luminal A型),完成新辅助化疗(NAC)后非病理完全缓解(npCR)。图a为自动乳腺超声图像显示冠状面汇聚征,无冠状面白墙征和皮肤侵犯;图b为列线图计算总得分为98分(0+0+98+0+0=98),对应于NAC后病理完全缓解(pCR)率为4% |
| 1 |
|
| 2 |
|
| 3 |
|
| 4 |
|
| 5 |
中国超声医学工程学会仪器工程开发专业委员会, 中国抗癌协会肿瘤影像专委会, 中华医学会超声医学分会浅表组织与血管学组. 自动乳腺容积超声技术专家共识(2022版) [J]. 中国超声医学杂志, 2022, 38(3): 241-247.
|
| 6 |
《中国乳腺癌新辅助治疗专家共识(2022年版)》专家组. 中国乳腺癌新辅助治疗专家共识(2022年版)[J].中国癌症杂志, 2022, 32(1): 80-89.
|
| 7 |
|
| 8 |
|
| 9 |
|
| 10 |
|
| 11 |
|
| 12 |
Early breast cancer trialists' collaborative group (EBCTCG). Long-term outcomes for neoadjuvant versus adjuvant chemotherapy in early breast cancer: meta-analysis of individual patient data from ten randomised trials [J]. Lancet Oncol, 2018, 19(1): 27-39.
|
| 13 |
|
| 14 |
|
| 15 |
|
| 16 |
|
| 17 |
|
| 18 |
|
| 19 |
|
| 20 |
|
| 21 |
|
| 22 |
|
| 23 |
|
| 24 |
|
| 25 |
|
| 26 |
|
| 27 |
|
| 28 |
|
| 29 |
|
| 30 |
|
| 31 |
|
| 32 |
唐益勇, 李晓琴, 施燕芸, 等. 超声结合钼靶成像及Ki-67表达对乳腺癌新辅助化疗疗效的预测价值 [J/OL]. 中华医学超声杂志(电子版), 2021, 18(6): 564-569.
|
| 33 |
|
/
| 〈 |
|
〉 |