

2024 , Vol. 21 >Issue 08: 770 - 777
DOI: https://doi.org/10.3877/cma.j.issn.1672-6448.2024.08.005
超声引导衰减参数成像评估肝脂肪变性及其对心血管疾病风险的预测价值
Copy editor: 汪荣
收稿日期: 2024-05-23
网络出版日期: 2024-09-11
基金资助
国家自然科学基金项目(82272000)
版权
Ultrasound guided attenuation parameter for evaluating hepatic steatosis and predicting risk of cardiovascular disease
Received date: 2024-05-23
Online published: 2024-09-11
Copyright
探讨超声引导衰减参数成像(UGAP)技术评估非酒精性脂肪性肝病(NAFLD)的相关影响因素及临床适用性,评估NAFLD患者并发心血管疾病(CVD)预测模型的应用价值。
纳入2022年11月至2023年11月于哈尔滨医科大学第一附属医院行二维超声及UGAP检查的NAFLD患者204例,另选取同期健康者73例作为对照组。受试者进行二维超声检查对肝脂肪变性程度进行评价,分为S0~S3级,所有受试者进行UGAP检查获取UGAP值。基于是否并发CVD事件,将NAFLD患者进一步分为并发CVD组83例与未并发CVD组121例。比较S0~S3组间UGAP值的差异,应用单因素和多因素线性回归分析影响UGAP值的独立影响因素。采用Spearman相关评估UGAP值与肝脂肪变性程度之间的相关性。使用组内相关系数(ICC)评估不同操作者之间测量结果的一致性。采用Logistic回归和Nomogram模型分析NAFLD患者并发CVD的危险因素,并应用ROC曲线及校正曲线评估该模型的临床效能。
277例受试者中,S0组73例(健康对照组),S1~S3组分别为83、86、35例。UGAP值在S0~S3各组间的差异存在统计学意义(H=236.35,P<0.001)。多因素线性回归分析表明,体质量指数(BMI)、总胆固醇(TC)、甘油三酯(TG)及肝脂肪变性程度是UGAP的独立影响因素(P均<0.05)。UGAP值操作者间的ICC为0.977(95%CI:0.972~0.982,P<0.001)。Logistic回归分析表明,年龄、BMI、UGAP值为NAFLD患者并发CVD的独立影响因素(P均<0.05),构建的Nomogram模型的ROC曲线下面积为0.948(95%CI:0.920~0.977,P<0.001)。校准曲线表明,模型的实际预测性能与理想预测性能接近。
UGAP值与BMI、血脂水平、肝脂肪变性程度密切相关,且操作者间可重复性好;基于年龄、BMI及UGAP值构建的Nomogram模型可直观地评价NAFLD患者并发CVD的风险。UGAP技术可为评估脂肪肝及其严重程度、预测CVD发生风险提供可靠依据。
郝玥萦 , 毛盈譞 , 张羽 , 汪佳旭 , 韩林霖 , 匡雯雯 , 孟瑶 , 杨秀华 . 超声引导衰减参数成像评估肝脂肪变性及其对心血管疾病风险的预测价值[J]. 中华医学超声杂志(电子版), 2024 , 21(08) : 770 -777 . DOI: 10.3877/cma.j.issn.1672-6448.2024.08.005
To investigate the influencing factors and clinical applicability of ultrasound-guided attenuation parameter (UGAP) in evaluating non-alcoholic fatty liver disease (NAFLD), and to evaluate the application value of cardiovascular disease (CVD) prediction models in NAFLD patients.
This study included 204 NAFLD patients who underwent conventional two-dimensional ultrasound (US) and UGAP assessments from November 2022 to November 2023 at the First Affiliated Hospital of Harbin Medical University, and 73 healthy subjects were selected as a control group. All the subjects underwent two-dimensional ultrasound examination to evaluate the degree of hepatic steatosis, which was divided into S0~S3 grades. All subjects underwent UGAP examination to obtain UGAP values. Based on the presence or absence of CVD events, NAFLD patients were further divided into into two groups: 83 patients with CVD and 121 without. The differences of UGAP values among the S0~S3 groups were compared, and the independent risk factors affecting UGAP values were identified by univariate and multivariate linear regression analyses. Spearman correlation analysis was performed to evaluate the correlation between UGAP values and the degree of hepatic steatosis. The intraclass correlation coefficient (ICC) was used to evaluate the consistency of measurements between different operators. Logistic regression and nomogram models were used to analyze the risk factors for CVD in NAFLD patients, and receiver operating characteristic (ROC) curve and calibration curve were used to evaluate the clinical efficacy of the model.
Among the 277 subjects, there were 73, 83, 86, and 35 cases in the S0~S3 groups, respectively. The differences in UGAP values among the S0~S3 groups were statistically significant (H=236.35, P<0.001). Multivariate linear regression analysis indicated that body mass index (BMI), total cholesterol (TC), triglycerides (TG), and the degree of hepatic steatosis were independent risk factors for UGAP (all P<0.05). The interrater ICC for UGAP was 0.977 (95% confidence interval [CI]: 0.972-0.982, P<0.001). Logistic regression analysis indicated that age, BMI, and UGAP values were independent influencing factors of CVD in NAFLD patients (P<0.05), and the area under the ROC curve of the nomogram model developed based on age, BMI, and UGAP values was 0.948 (95%CI: 0.920-0.977, P<0.001). The calibration curve showed that the actual prediction performance of the model was close to the ideal prediction performance.
UGAP values closely correlate with BMI and the degree of liver fatty degeneration, exhibiting excellent reproducibility among operators. The nomogram model constructed based on age, BMI, and UGAP values, intuitively evaluates the risk of concurrent CVD in NAFLD patients. Thus, UGAP provides a reliable basis for evaluating fatty liver and its severity and predicting the risk of CVD.
 ±s表示,2组间比较采用独立样本t检验。非正态分布的数据,以M(P25,P75)表示,2组间比较采用非参数检验。计数资料以例(%)表示,2组间比较采用χ2检验。应用单因素和多因素线性回归分析各变量与UGAP值之间的关联。将单因素分析中P<0.05的变量纳入多因素回归分析,确定UGAP值的独立影响因素。此外,采用Spearman等级相关来评估UGAP值与肝脂肪变性二维超声诊断分级之间的相关性;采用Kruskal-Wallis检验比较不同程度肝脂肪变性的UGAP值差异。受试者间UGAP值的一致性通过计算组内相关系数(intraclass correlation coefficient,ICC)来评估。采用Logistic回归和Nomogram模型分析NAFLD患者并发CVD的危险因素,并应用ROC曲线及校正曲线评估该模型的临床效能。P<0.05为差异具有统计学意义。
±s表示,2组间比较采用独立样本t检验。非正态分布的数据,以M(P25,P75)表示,2组间比较采用非参数检验。计数资料以例(%)表示,2组间比较采用χ2检验。应用单因素和多因素线性回归分析各变量与UGAP值之间的关联。将单因素分析中P<0.05的变量纳入多因素回归分析,确定UGAP值的独立影响因素。此外,采用Spearman等级相关来评估UGAP值与肝脂肪变性二维超声诊断分级之间的相关性;采用Kruskal-Wallis检验比较不同程度肝脂肪变性的UGAP值差异。受试者间UGAP值的一致性通过计算组内相关系数(intraclass correlation coefficient,ICC)来评估。采用Logistic回归和Nomogram模型分析NAFLD患者并发CVD的危险因素,并应用ROC曲线及校正曲线评估该模型的临床效能。P<0.05为差异具有统计学意义。表1 NAFLD组与对照组一般临床资料比较[M(P25,P75)] |
| 临床资料 | 对照组(n=73) | NAFLD组(n=204) | 统计值 | P值 |
|---|---|---|---|---|
| 年龄(岁) | 56.5(47,64) | 56(50,63) | Z=-0.035 | 0.972 |
| BMI(kg/m2) | 22.75(21.85,23.55) | 26.90(25.6,27.7) | Z=-11.490 | <0.001 |
| SLD(cm) | 2.19(1.75,2.42) | 2.13(1.88,2.36) | Z=-0.094 | 0.925 |
| ALT(U/L) | 22.75(18.1,27.15) | 50.50(44.7,60.05) | Z=-11.339 | <0.001 |
| AST(U/L) | 22.95(18.35,26.7) | 53.60(44.15,65.2) | Z=-11.234 | <0.001 |
| GGT(U/L) | 58.55(34.2,86.05) | 63.40(35.9,87.15) | Z=-0.363 | 0.717 |
| Glu(mmol/L) | 5.08(4.67,5.62) | 5.91(5.63,7.06) | Z=-7.595 | <0.001 |
| TC(mmol/L) | 3.75(3.21,4.15) | 5.26(4.98,5.86) | Z=-12.564 | <0.001 |
| TG(mmol/L) | 1.16(0.94,1.35) | 2.28(1.89,2.69) | Z=-12.746 | <0.001 |
| HDL(mmol/L) | 1.21(0.88,1.36) | 1.04(0.92,1.17) | Z=-2.425 | 0.015 |
| LDL(mmol/L) | 3.06(2.32,3.69) | 3.09(2.82,3.63) | Z=-0.492 | 0.623 |
TP(g/L,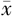 ±s) ±s) | 67.00±5.75 | 68.02±5.99 | t =-1.264 | 0.207 |
| AKP(U/L) | 73.8(60.2,89.75) | 73.4(64.05,87.8) | Z=-0.788 | 0.431 |
| UGAP-1(dm/cm/MHz) | 0.61(0.59,0.62) | 0.71(0.68,0.74) | Z=-11.498 | <0.001 |
| UGAP-2(dm/cm/MHz) | 0.62(0.6,0.63) | 0.72(0.69,0.76) | Z=-11.462 | <0.001 |
注:BMI为体质量指数;SLD为皮肤-肝包膜距离;ALT为丙氨酸氨基转移酶;AST为门冬氨酸氨基转移酶;GGT为γ-谷氨酰转移酶;Glu为血糖;TC为总胆固醇;TG为甘油三酯;HDL为高密度脂蛋白;LDL为低密度脂蛋白;TP为总蛋白;AKP为碱性磷酸酶;UGAP-1、UGAP-2分别为2位检查医师测量的超声引导衰减参数;NAFLD为非酒精性脂肪性肝病 |
表2 影响NAFLD患者UGAP值的单因素线性回归分析 |
| 因素 | 非标准化系数 | 标准化系数 | t值 | P值 | R2 | 调整R2 | F(P)值 | |
|---|---|---|---|---|---|---|---|---|
| B | 标准误 | Beta | ||||||
| 年龄 | 0 | 0 | 0.043 | 0.708 | 0.479 | 0.002 | -0.002 | 0.502(0.479) |
| BMI | 0.022 | 0 | 0.936 | 44.099 | <0.001 | 0.876 | 0.876 | 1944.6395(<0.001) |
| SLD | 0.001 | 0.012 | 0.006 | 0.099 | 0.921 | 0 | -0.004 | 0.01(0.921) |
| ALT | 0.004 | 0 | 0.971 | 67.354 | <0.001 | 0.943 | 0.943 | 4536.536(<0.001) |
| AST | 0.002 | 0 | 0.841 | 25.778 | <0.001 | 0.708 | 0.707 | 664.486(<0.001) |
| GGT | 0 | 0 | 0.059 | 0.98 | 0.328 | 0.003 | 0 | 0.96(0.328) |
| Glu | 0.026 | 0.002 | 0.583 | 11.887 | <0.001 | 0.339 | 0.337 | 141.308(<0.001) |
| TC | 0.068 | 0.001 | 0.955 | 53.408 | <0.001 | 0.912 | 0.912 | 2852.434(<0.001) |
| TG | 0.079 | 0.001 | 0.959 | 55.858 | <0.001 | 0.919 | 0.919 | 3120.156(<0.001) |
| HDL | -0.029 | 0.018 | -0.098 | -1.633 | 0.104 | 0.01 | 0.006 | 2.666(0.104) |
| LDL | -0.009 | 0.005 | -0.106 | -1.763 | 0.079 | 0.011 | 0.008 | 3.109(0.079) |
| TP | 0.001 | 0.001 | 0.11 | 1.832 | 0.068 | 0.012 | 0.008 | 3.357(0.068) |
| AKP | 0 | 0 | 0.062 | 1.025 | 0.306 | 0.004 | 0 | 1.051(0.306) |
| 肝脂肪变性程度 | 0.064 | 0.002 | 0.908 | 35.842 | <0.001 | 0.824 | 0.823 | 1284.649(<0.001) |
注:BMI为体质量指数;SLD为皮肤-肝包膜距离;ALT为丙氨酸氨基转移酶;AST为门冬氨酸氨基转移酶;GGT为γ-谷氨酰转移酶;Glu为血糖;TC为总胆固醇;TG为甘油三酯;HDL为高密度脂蛋白;LDL为低密度脂蛋白;TP为总蛋白;AKP为碱性磷酸酶;UGAP为超声引导衰减参数;NAFLD为非酒精性脂肪性肝病 |
表3 影响NAFLD患者UGAP值的多因素线性回归分析 |
| 因素 | 非标准化系数 | 标准化系数 | t值 | P值 | VIF | R2 | 调整R2 | F(P)值 | |
|---|---|---|---|---|---|---|---|---|---|
| B | 标准误 | Beta | |||||||
| 常数 | 0.387 | 0.011 | 35.057 | <0.001 | - | 0.976 | 0.976 | 1841.781(<0.001) | |
| BMI | 4.0×10-3 | 0.001 | 0.190 | 7.691 | <0.001 | 6.906 | |||
| AST | 5.75×10-5 | 0 | 0.024 | 1.330 | 0.185 | 3.652 | |||
| Glu | 0 | 0.001 | -0.006 | -0.465 | 0.643 | 1.600 | |||
| TC | 0.024 | 0.002 | 0.332 | 13.265 | <0.001 | 7.112 | |||
| TG | 0.028 | 0.002 | 0.339 | 11.959 | <0.001 | 9.081 | |||
| 肝脂肪变性程度 | 0.011 | 0.001 | 0.153 | 7.463 | <0.001 | 4.774 | |||
注:BMI为体质量指数;AST为门冬氨酸氨基转移酶;Glu为血糖;TC为总胆固醇;TG为甘油三酯;UGAP为超声引导衰减参数;NAFLD为非酒精性脂肪性肝病 |
表4 UGAP值的操作者间一致性分析 |
| 参数 | 组内相关系数 | 95%CI | P值 |
|---|---|---|---|
| 总体 | 0.977 | 0.972~0.982 | <0.001 |
| 肝脂肪变性诊断分级 | |||
| S0 | 0.885 | 0.823~0.926 | <0.001 |
| S1 | 0.851 | 0.779~0.901 | <0.001 |
| S2 | 0.887 | 0.832~0.925 | <0.001 |
| S3 | 0.909 | 0.827~0.953 | <0.001 |
注:UGAP为超声引导衰减参数 |
表5 NAFLD合并CVD组与未合并CVD组患者的基线资料比较[M(P25,P75)] |
| 资料 | NAFLD合并CVD组(n=83) | NAFLD未合并CVD组(n=121) | 统计值 | P值 |
|---|---|---|---|---|
| 年龄(岁) | 62(57,66) | 52(46,58) | Z=-7.269 | <0.001 |
| BMI(kg/m2) | 27.6(26.7,29.6) | 26.3(25.1,27.2) | Z=-6.223 | <0.001 |
| 收缩压(mmHg) | 130(130,140) | 125(120,140) | Z=-3.846 | <0.001 |
| 舒张压(mmHg) | 85(80,90) | 83(80,90) | Z=-0.364 | 0.715 |
| UGAP(dm/cm/MHz) | 0.76(0.71,0.81) | 0.69(0.68,0.72) | Z=-7.483 | <0.001 |
| TC(mmol/L) | 4.95(4.15,5.51) | 5.14(4.78,5.63) | Z=-1.903 | 0.057 |
| TG(mmol/L) | 1.94(1.53,2.44) | 2.01(1.48,2.53) | Z=-0.464 | 0.643 |
HDL(mmol/L,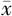 ±s) ±s) | 1.05±0.20 | 1.06±0.21 | t =0.242 | 0.809 |
| LDL(mmol/L) | 3.13(2.32,3.66) | 3.07(2.89,3.58) | Z=-0.744 | 0.457 |
| Glu(mmol/L) | 6.39(5.86,7.99) | 5.78(5.43,6.09) | Z=-6.00 | <0.001 |
| 性别[例(%)] | χ2=0.915 | 0.339 | ||
| 男性 | 41(37.6) | 68(62.4) | ||
| 女性 | 42(44.2) | 53(55.8) | ||
| 吸烟[例(%)] | χ2=17.043 | <0.001 | ||
| 否 | 32(28.1) | 82(71.9) | ||
| 是 | 51(56.7) | 39(43.3) |
注:1 mmHg=0.133 kPa;BMI为体质量指数;UGAP为超声引导衰减参数;TC为总胆固醇;TG为甘油三酯;HDL为高密度脂蛋白;LDL为低密度脂蛋白;Glu为血糖;NAFLD为非酒精性脂肪性肝病;CVD为心血管疾病 |
表6 NAFLD合并CVD的多因素逐步Logistic回归分析 |
| 因素 | B | 标准误差 | Wald χ2值 | P值 | OR值 | 95%CI |
|---|---|---|---|---|---|---|
| 年龄 | 0.29 | 0.047 | 38.2 | <0.001 | 1.337 | 1.219~1.466 |
| BMI | -0.473 | 0.205 | 5.321 | 0.021 | 0.623 | 0.417~0.931 |
| UGAP | 69.919 | 13.449 | 27.027 | <0.001 | 2.32×1030 | 8.27×1018~6.51×1041 |
| 常量 | -54.662 | 8.212 | 44.31 | <0.001 | 0 |
注:BMI身体质量指数;UGAP为超声引导衰减参数 |
| 1 |
|
| 2 |
邵幼林, 范建高. 非酒精性脂肪性肝病的流行现状与危害[J]. 中华肝脏病杂志, 2019, 27(1): 10-13.
|
| 3 |
|
| 4 |
|
| 5 |
|
| 6 |
|
| 7 |
中华医学会肝脏病学分会脂肪肝和酒精性肝病学组. 非酒精性脂肪性肝病诊疗指南 [J/CD]. 中国肝脏病杂志(电子版), 2010, 2(4): 43-48.
|
| 8 |
|
| 9 |
|
| 10 |
|
| 11 |
张记, 闫艳, 李金燕. 超声声衰减成像对不同程度非酒精性脂肪肝的诊断价值 [J]. 临床超声医学杂志, 2023, 25(9): 718-722.
|
| 12 |
|
| 13 |
|
| 14 |
沈峰, 范建高. 瞬时弹性成像技术在脂肪性肝病中的应用现状 [J]. 中华肝脏病杂志, 2014, 22(9): 643-646.
|
| 15 |
|
| 16 |
|
| 17 |
邢敏, 杨自力. 血脂、血糖、肝功能等生化指标联合超声诊断脂肪肝及评估其预后的价值 [J]. 肝脏, 2016, 21(4): 327-328.
|
| 18 |
吴成忠, 陈磊, 张丽. 超声诊断脂肪肝与血脂水平及肝功能的相关性评价 [J]. 影像研究与医学应用, 2020, 4(14): 185-186.
|
| 19 |
|
| 20 |
|
| 21 |
|
| 22 |
|
/
| 〈 |
|
〉 |