

2025 , Vol. 22 >Issue 08: 768 - 776
DOI: https://doi.org/10.3877/cma.j.issn.1672-6448.2025.08.012
射血分数保留肝硬化患者的肝脏硬度与左心室功能超声特征及相关性分析
通信作者:
尹立雪,Email:yinlixue_cardiac@163.comCopy editor: 汪荣
收稿日期: 2025-03-17
网络出版日期: 2025-09-29
基金资助
国家重点研发计划项目(2020YFC2008000)
版权
Ultrasound characteristics and correlation of liver hardness and left ventricular function in patients with liver cirrhosis with preserved ejection fraction
Corresponding author:
Yin Lixue, Email: yinlixue_cardiac@163.comReceived date: 2025-03-17
Online published: 2025-09-29
Copyright
应用肝脏二维剪切波弹性成像(2D-SWE)与超声心肌做功(MW)技术,分析射血分数保留肝硬化患者在不同Child-Pugh分级下的肝脏硬度与左心室功能改变及二者相关性。
选取2023年8月至2024年12月于成都市温江区人民医院就诊的射血分数保持正常的肝硬化患者110例。按照Child-Pugh分级标准,将患者分为A级组34例、B级组37例和C级组39例;选取36例年龄和性别相匹配的健康志愿者作为对照组。收集一般临床资料、血生化检验指标、肝脏硬度值(LSM)、常规超声心动图参数、二维斑点追踪及MW参数。比较各组间上述参数差异并分析Child-Pugh分级、LSM与血生化指标、二维斑点追踪及MW参数的相关性。
肝脏硬度值比较:A级组LSM较对照组增高(P<0.001),B级组LSM较对照组、A级组增高(P<0.001),C级组LSM较对照组及A、B级组增高(P<0.05)。左心室舒张功能参数比较:A、B级组e'峰较对照组降低(P<0.001),C级组e'峰较对照组及A、B级组减低(P<0.001);B级组E/A值较对照组降低(P<0.001),C级组E/A值较对照组及A、B级组均减低(P<0.001);B级组e'/a'值较对照组减低(P<0.001),C级组e'/a'值较对照组及A、B级组均减低(P<0.001)。左心室收缩功能参数比较:B、C级组左心室射血分数较对照组增加(P<0.05);B级组左心室整体纵向应变(GLS)绝对值较对照组、A级组增加(P<0.001);C级组GLS绝对值较B级组降低(P<0.001);C级组峰值应变离散度(PSD)较对照组、A级组增加(P<0.001);B级组整体有用功(GCW)较对照组增加(P<0.001);C级组GCW较B级组降低(P<0.001);C级组整体做功指数(GWI)、整体做功效率(GWE)较对照组及A、B级组降低(P<0.001);C级组整体无用功(GWW)较对照组及A、B级组增高(P<0.001)。相关性分析:Child-Pugh分级与LSM、谷草转氨酶、总胆汁酸、GWW呈正相关(r=0.872、0.499、0.533、0.446,P<0.001),与舒张压、E/A、e'、e'/a'、GWE呈负相关(r=-0.483、-0.562、-0.669、-0.659、-0.479,P<0.001)。LSM与心输出量、谷草转氨酶、总胆汁酸呈正相关(r=0.467、0.584、0.585,P<0.001),与舒张压、E/A、e'、e'/a'呈负相关(r=-0.513、-0.491、-0.542、-0.571,P<0.001)。
随着肝硬化Child-Pugh分级进展,肝脏功能障碍加重,肝脏硬度测值增高且离散度增大;左心室舒张功能降低,收缩功能先代偿性增强后失代偿性降低。肝-心功能损伤存在协同作用。综合应用2D-SWE与MW技术可更全面、有效地评估肝硬化患者的肝脏病变程度及左心室功能变化,为临床精准分层干预和改善患者预后提供重要影像学依据。
张俊清 , 周秘 , 张文军 , 谭静 , 尹立雪 . 射血分数保留肝硬化患者的肝脏硬度与左心室功能超声特征及相关性分析[J]. 中华医学超声杂志(电子版), 2025 , 22(08) : 768 -776 . DOI: 10.3877/cma.j.issn.1672-6448.2025.08.012
To make a comprehensive analysis of liver stiffness and left ventricular functional changes and their correlations in cirrhosis patients with preserved ejection fraction across Child-Pugh classes using two-dimensional shear wave elastography (2D-SWE) and myocardial work (MW).
A total of 110 cirrhosis patients with preserved left ventricular ejection fraction (LVEF) were recruited from Wenjiang District People's Hospital, Chengdu between August 2023 and December 2024. According to Child-Pugh classification, the patients were stratified into Group A (n=34), Group B (n=37), and Group C (n=39). Thirty-six age- and sex-matched healthy volunteers served as controls. Demographics, blood biochemical parameters, liver stiffness measurements (LSM), conventional echocardiographic indices, 2D-SWE, and MW parameters were collected. Intergroup differences were compared and correlations among parameters were analyzed.
LSM was higher in Group A than in controls (P<0.001). Group B showed higher LSM than both controls and Group A (P<0.001). Group C exhibited higher LSM than controls, Group A, and Group B (P<0.05). In terms of LV diastolic function parameters, e' was decreased in Groups A and B compared to the control group (P<0.001), and demonstrated a further reduction in Group C compared to the control group and groups A and B (P<0.001). E/A ratio was lower in Group B than in controls (P<0.001), and was further reduced in Group C compared to the control group and groups A and B (P<0.001). e'/a' ratio was reduced in Group B compared to controls (P<0.001), with Group C showing a more significant decrease compared to the control group and groups A and B (P<0.001). In terms of left ventricular systolic function parameters, LVEF was significantly higher in Groups B and C compared to the control group (P<0.05). The absolute value of global longitudinal strain (GLS) was significantly increased in Group B compared to both the control group and Group A (P<0.001). The absolute GLS value was significantly lower in Group C than in Group B (P<0.001). Peak strain dispersion (PSD) was significantly increased in Group C compared to the control group and Group A (P<0.001). Global constructive work (GCW) was significantly higher in Group B than in controls (P<0.001). GCW was significantly lower in Group C than in Group B (P<0.001). Global work index (GWI) and global work efficiency (GWE) were significantly reduced in Group C compared to the control group, Group A, and Group B (P<0.001). Global wasted work (GWW) was significantly elevated in Group C compared to the control group, Group A, and Group B (P<0.001). Child-Pugh grade correlated positively with LSM, AST, TBA, and GWW (r= 0.872, 0.499, 0.533, and 0.446, respectively; P<0.001), and negatively with DBP, E/A, e', e'/a', and GWE (r=−0.483, −0.562, −0.669, −0.659, and −0.479, respectively; P<0.001). LSM showed positive correlations with CO, AST, and TBA (r=0.467, 0.584, and 0.585, respectively; P<0.001), and negative correlations with DBP, E/A, e', and e'/a' (r=−0.513, −0.491, −0.542, and −0.571, respectively; P<0.001).
With the worsening of Child-Pugh classification in liver cirrhosis, liver dysfunction deteriorates, accompanied by increased LSM values and heightened measurement dispersion, left ventricular diastolic function declines, and systolic function initially exhibits compensatory enhancement but subsequently undergoes decompensatory reduction. Liver-heart functional impairment demonstrates synergistic effects. The combined use of 2D-SWE and MW techniques provided a more comprehensive and effective assessment of liver disease severity and left ventricular functional changes in cirrhotic patients, which offered crucial imaging evidence for targeted clinical interventions and improving patient prognosis.
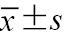
表1 不同Child-Pugh分级组及健康对照组一般资料比较 |
| 临床资料 | 对照组(n=36) | A级组(n=34) | B级组(n=37) | C级组(n=39) | 统计值 | P值 |
|---|---|---|---|---|---|---|
| 男性[例,(%)] | 25(69.4) | 24(70.6) | 24(64.9) | 28(71.8) | χ2=0.481 | 0.923 |
| 年龄(岁) | 57.85±9.64 | 56.18±11.83 | 59.59±11.83 | 60.92±10.08 | F=1.444 | 0.233 |
| 体质量指数(kg/m2) | 23.16±2.82 | 23.60±2.96 | 22.27±3.20 | 21.76±2.73 | F=2.883 | 0.038 |
| 体表面积(m2) | 1.66±0.16 | 1.67±0.13 | 1.61±0.19 | 1.60±0.16 | F=1.680 | 0.174 |
| 收缩压(mmHg) | 119.83±4.14 | 122.00(12.00) | 116.00(11.00) | 114.23±7.19 | H=17.436 | 0.001 |
| 舒张压(mmHg) | 79.97±4.40 | 80.00(9.00) | 72.46±8.52 | 71.41±7.27 | H=36.790 | <0.001 |
| 心率(次/min) | 70.42±9.13 | 75.18±12.61 | 73.44(20.61) | 77.15±14.36 | H=5.807 | 0.121 |
注:1 mmHg=0.133 kPa;与对照组比较,aP<0.05;与A级组比较,bP<0.05;表中符合正态分布的计量资料以 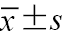 |
表2 不同Child-Pugh分级组及健康对照组血生化检验指标比较 |
| 生化指标 | 对照组(n=36) | A级组(n=34) | B级组(n=37) | C级组(n=39) | H值 | P值 |
|---|---|---|---|---|---|---|
| ALT(U/L) | 24.00(9.25) | 42.00(43.00) | 26.00(43.00) | 29.00(39.00) | 11.878 | 0.008 |
| AST(U/L) | 25.56±5.29 | 38.50(54.25) | 48.00(45.00) | 58.00(60.00) | 45.917 | <0.001 |
| TBA(μmol/L) | 5.05(6.90) | 7.65(18.60) | 28.10(56.30) | 31.00(43.50) | 47.078 | <0.001 |
| TBIL(μmol/L) | 16.26±4.92 | 19.10(9.58) | 25.00(25.20) | 28.00(28.10) | 31.346 | <0.001 |
注:ALT为谷丙转氨酶;AST为谷草转氨酶;TBA为总胆汁酸;TBIL为总胆红素;与对照组比较,aP<0.05;与A级组比较,bP<0.05;表中符合正态分布的计量资料以 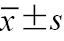 |
表3 不同Child-Pugh分级组及健康对照组肝脏硬度值及常规超声心动图参数比较 |
| 参数 | 对照组(n=36) | A级组(n=34) | B级组(n=37) | C级组(n=39) | 统计值 | P值 |
|---|---|---|---|---|---|---|
| LSM(kPa) | 4.88±0.66 | 11.70(2.20) | 22.80(18.30) | 31.80(32.90) | H=115.670 | <0.001 |
| IVSTD(mm) | 8.43±0.73 | 8.72±0.82 | 9.00(1.30) | 9.43±1.37 | H=15.330 | 0.002 |
| LVPWD(mm) | 8.00(1.00) | 8.27±0.72 | 8.30(1.10) | 8.68±0.88 | H=10.791 | 0.013 |
| LVEDD(mm) | 43.20(6.15) | 45.22±2.74 | 46.32±3.86 | 45.00(4.80) | H=10.703 | 0.013 |
| LVMI(g/m2) | 68.44±11.46 | 74.77±9.85 | 85.88±17.23 | 81.27±14.65 | F=11.284 | <0.001 |
| SV(ml) | 53.03±9.75 | 52.21±8.52 | 57.00(19.00) | 59.51±12.04 | H=11.663 | 0.009 |
| CO(L) | 3.50(1.00) | 3.88±0.72 | 4.30(1.90) | 4.40(1.10) | H=20.710 | <0.001 |
注:LSM为肝脏硬度值;IVSTD为室间隔舒张末期厚度;LVPWD为左心室后壁舒张末期厚度;LVEDD为左心室舒张末期内径;SV为每搏量;CO为心输出量;LVMI为左心室质量指数;与对照组比较,aP<0.05;与A级组比较,bP<0.05;与B级组比较,cP<0.05;表中符合正态分布的计量资料以 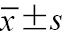 |
表4 不同Child-Pugh分级组及健康对照组左心室舒张功能参数比较 |
| 参数 | 对照组(n=36) | A级组(n=34) | B级组(n=37) | C级组(n=39) | 统计值 | P值 |
|---|---|---|---|---|---|---|
| E(cm/s) | 84.03±14.57 | 79.18±17.73 | 76.32±11.84 | 68.03±9.70 | F=11.796 | <0.001 |
| A(cm/s) | 78.81±8.47 | 80.97±8.83 | 86.22±10.83 | 92.44±12.61 | F=12.773 | <0.001 |
| e'(cm/s) | 9.31±1.37 | 7.76±1.46 | 7.35±1.33 | 6.00(2.00) | H=67.097 | <0.001 |
| a'(cm/s) | 9.56±1.68 | 9.24±1.62 | 10.22±2.29 | 10.79±1.75 | F=5.153 | 0.002 |
| E/A | 1.08±0.23 | 0.91(0.40) | 0.83(0.29) | 0.71(0.12) | H=47.651 | <0.001 |
| E/e' | 9.04(1.67) | 9.62(2.39) | 10.62±2.07 | 10.71(3.00) | H=23.917 | <0.001 |
| e'/a' | 0.90(0.46) | 0.87±0.25 | 0.71(0.30) | 0.55(0.08) | H=65.045 | <0.001 |
注:E为二尖瓣口舒张早期峰值速度;A为二尖瓣口舒张晚期峰值速度;e'为二尖瓣环舒张早期峰值速度;a'为二尖瓣环舒张晚期峰值速度;E/A为二尖瓣口舒张早期/晚期血流峰值速度比值;E/e'为二尖瓣口舒张早期血流峰值速度/二尖瓣环舒张晚期峰值速度比值;e'/a'为二尖瓣环舒张早期/舒张晚期峰值速度比值;与对照组比较,aP<0.05;与A级组比较,bP<0.05;与B级组比较,cP<0.05;表中符合正态分布的计量资料以 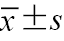 |
表5 不同Child-Pugh分级组及健康对照组左心室收缩功能参数比较 |
| 参数 | 对照组(n=36) | A级组(n=34) | B级组(n=37) | C级组(n=39) | 统计值 | P值 |
|---|---|---|---|---|---|---|
| LVEF(%) | 61.00(2.00) | 62.00(2.00) | 62.78±3.13 | 63.64±3.16 | H=16.699 | 0.001 |
| GLS(%) | 20.28±1.21 | 20.98±1.89 | 22.75±2.41 | 19.80(5.40) | H=30.916 | <0.001 |
| PSD(ms) | 29.31±7.14 | 33.85±10.99 | 34.00(12.00) | 43.00(29.00) | H=22.818 | <0.001 |
| GCW(mmHg%) | 2164.56±137.25 | 2213.06±267.79 | 2352.16±204.49 | 2048.13±302.95 | F=10.727 | <0.001 |
| GWI(mmHg%) | 1906.00±119.53 | 1932.97±265.53 | 2074.00(373.00) | 1703.23±256.42 | H=34.656 | <0.001 |
| GWE(%) | 98.00(1.00) | 98.00(1.00) | 97.00(1.50) | 95.50(3.00) | H=40.331 | <0.001 |
| GWW(mmHg%) | 37.56±10.54 | 42.56±21.18 | 49.43±21.53 | 75.00(65.00) | H=30.936 | <0.001 |
注:LVEF为左心室射血分数;GLS为整体纵向应变;PSD为峰值应变离散度;GCW为整体有用功;GWI为整体做功指数;GWE为整体做功效率;GWW为整体无用功;与对照组比较,aP<0.05;与A级组比较,bP<0.05;与B级组比较,cP<0.05;表中符合正态分布的计量资料以 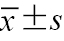 |
表6 Child-Pugh分级、LSM与生化指标及超声心动图参数的相关性分析 |
| 相关因素 | 与Child-Pugh分级的相关性 | 与LSM的相关性 | ||
|---|---|---|---|---|
| r值 | P值 | r值 | P值 | |
| Child-Pugh分级 | - | - | 0.872 | <0.001 |
| LSM | 0.872 | <0.001 | - | - |
| DBP | -0.483 | <0.001 | -0.513 | <0.001 |
| E/A | -0.562 | <0.001 | -0.491 | <0.001 |
| e' | -0.669 | <0.001 | -0.542 | <0.001 |
| e'/a' | -0.659 | <0.001 | -0.571 | <0.001 |
| CO | 0.370 | <0.001 | 0.467 | <0.001 |
| AST | 0.499 | <0.001 | 0.584 | <0.001 |
| TBA | 0.533 | <0.001 | 0.585 | <0.001 |
| GLS | 0.072 | 0.389 | 0.265 | 0.001 |
| PSD | 0.392 | <0.001 | 0.302 | <0.001 |
| GWE | -0.479 | <0.001 | -0.324 | <0.001 |
| GWI | -0.242 | 0.003 | -0.136 | 0.101 |
| GCW | -0.065 | 0.435 | 0.021 | 0.805 |
| GWW | 0.446 | <0.001 | 0.291 | <0.001 |
注:LSM为肝脏硬度值;DBP为舒张压;E/A为二尖瓣口舒张早期/晚期血流峰值速度比值;e'为二尖瓣环舒张早期峰值速度;e'/a'为二尖瓣环舒张早期/舒张晚期峰值速度比值;CO为心输出量;AST为谷草转氨酶;TBA为总胆汁酸;GLS为整体纵向应变;PSD为峰值应变离散度;GCW为整体有用功;GWI为整体做功指数;GWE为整体做功效率;GWW为整体无用功;-表示无相关数据 |
| 1 |
|
| 2 |
|
| 3 |
|
| 4 |
|
| 5 |
|
| 6 |
|
| 7 |
李沁园, 董常峰, 冯程, 等.基于弹性成像多模态法评估慢性乙型肝炎肝纤维化程度[J/OL].中华医学超声杂志(电子版), 2022, 19(9): 976-982.
|
| 8 |
|
| 9 |
|
| 10 |
|
| 11 |
|
| 12 |
中华医学会肝病学分会, 中华医学会消化病学分会. 终末期肝病临床营养指南[J].中华肝脏病杂志, 2019, 27(5): 330-342.
|
| 13 |
|
| 14 |
|
| 15 |
|
| 16 |
|
| 17 |
|
| 18 |
陈相林, 丁珺, 程翅, 等.交感神经系统在肝硬化及其并发症中的作用研究进展[J].中国医学科学院学报, 2024, 46(1): 128-134.
|
| 19 |
|
| 20 |
|
| 21 |
|
| 22 |
|
| 23 |
|
/
| 〈 |
|
〉 |