资料与方法
一、对象
二、仪器与方法
(一)仪器
(二)图像采集
(三)临床病理特征及NAC疗效病理评估标准
(四)临床模型构建
(五)影像组学模型构建
1.感兴趣区勾画及特征提取:
2.特征降维及模型构建:
(六)临床-影像组学联合模型构建
三、统计学分析
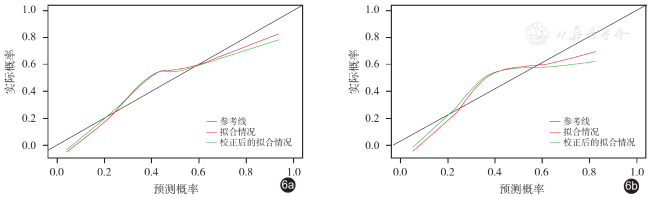
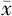 ±s表示,两组间比较采用独立样本t检验。计数资料以例数(%)表示,两组间比较采用χ 2检验或Fisher确切概率检验。采用单因素Logistic回归分析筛选出P < 0.01的临床特征进行多因素Logistic回归构建临床模型。采用LASSO回归筛选出最佳影像组学特征构建影像组学模型。采用多因素Logistic回归构建联合临床病理特征和Radscore的联合模型。采用Hosmer-Lemeshow检验评价模型的拟合优度,P > 0.05表示模型拟合效果好。以ROC曲线、校准曲线和决策曲线评价模型的区分度、校准度和临床适用性,并绘制模型列线图。以P < 0.05为差异有统计学意义。
±s表示,两组间比较采用独立样本t检验。计数资料以例数(%)表示,两组间比较采用χ 2检验或Fisher确切概率检验。采用单因素Logistic回归分析筛选出P < 0.01的临床特征进行多因素Logistic回归构建临床模型。采用LASSO回归筛选出最佳影像组学特征构建影像组学模型。采用多因素Logistic回归构建联合临床病理特征和Radscore的联合模型。采用Hosmer-Lemeshow检验评价模型的拟合优度,P > 0.05表示模型拟合效果好。以ROC曲线、校准曲线和决策曲线评价模型的区分度、校准度和临床适用性,并绘制模型列线图。以P < 0.05为差异有统计学意义。结果
一、临床病理特征筛选及临床模型构建
表1 训练集与验证集患者的临床病理资料[例(%)] |
| 临床病理资料 | 训练集 | 验证集 | ||
|---|---|---|---|---|
| pCR(n=44) | non-pCR(n=63) | pCR(n=38) | non-pCR(n=57) | |
年龄(岁,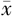 ±s) ±s) | 49.15±8.19 | 48.74±7.26 | 47.63±9.25 | 48.46±8.33 |
| 绝经状态 | ||||
| 绝经前 | 26(59.1) | 40(63.5) | 23(60.5) | 38(66.7) |
| 绝经后 | 18(40.9) | 23(36.5) | 15(39.5) | 19(33.3) |
| 临床T分期 | ||||
| 1~2期 | 24(54.5) | 37(58.7) | 21(55.3) | 34(59.6) |
| 3~4期 | 20(45.5) | 26(41.3) | 17(44.7) | 23(40.4) |
| 临床N分期 | ||||
| 0~1期 | 26(59.1) | 38(60.3) | 22(57.9) | 35(61.4) |
| 2~3期 | 18(40.9) | 25(39.7) | 16(42.1) | 22(38.6) |
| HR状态 | ||||
| 阴性 | 24(54.5) | 17(27.0) | 20(52.6) | 16(28.1) |
| 阳性 | 20(45.5) | 46(73.0) | 18(47.4) | 41(71.9) |
| HER2状态 | ||||
| 阴性 | 22(50.0) | 47(74.6) | 20(52.6) | 42(73.7) |
| 阳性 | 22(50.0) | 16(25.4) | 18(47.4) | 15(26.3) |
| Ki-67水平 | ||||
| 低表达 | 7(15.9) | 9(14.3) | 7(18.4) | 7(12.3) |
| 高表达 | 37(84,1) | 54(85.7) | 31(81.6) | 50(87.7) |
| 分子分型 | ||||
| Luminal A型 | 12(27.3) | 37(58.7) | 10(26.3) | 32(56.1) |
| Luminal B型 | 8(18.2) | 9(14.3) | 7(18.4) | 10(17.5) |
| HER2过表达型 | 14(31.8) | 8(12.7) | 12(31.6) | 7(12.3) |
| 三阴型 | 10(22.7) | 9(14.3) | 9(23.7) | 8(14.0) |
注:pCR为病理完全缓解;non-pCR为非病理完全缓解;HR为激素受体;HER2为人类表皮生长因子受体2;Ki-67为增殖细胞核抗原 |
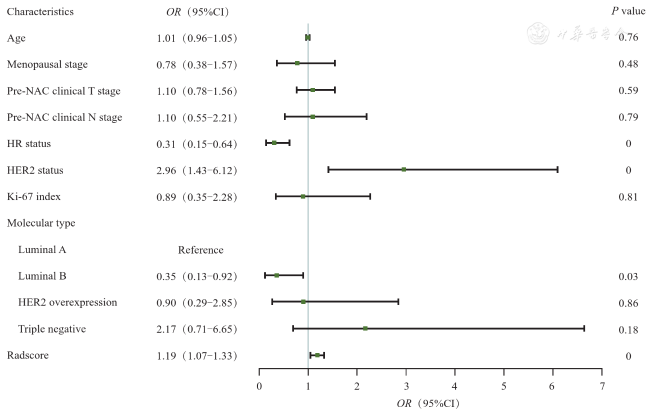
图3 森林图展示训练集各临床病理特征及影像组学评分的单因素Logistics回归分析结果注:Characteristics为特征;Age为年龄;Menopausal stage为绝经状态;Pre-NAC clinical T stage为临床T分期;Pre-NAC clinical N stage为临床N分期;HR status为激素受体状态;HER2 status为人类表皮生长因子受体2状态;Ki-67 index为增殖细胞核抗原水平;Molecular type为分子分型;HER2 overexpression为HER2过表达型;Triple negative为三阴型;Radscore为影像组学评分;OR为比值比;95%CI为95%置信区间;P value为P值 |
二、影像组学特征及模型构建
三、临床-影像组学联合模型
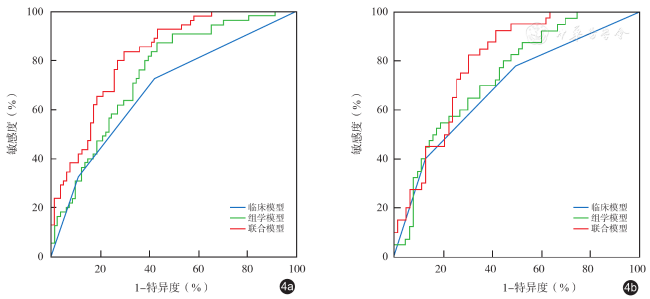
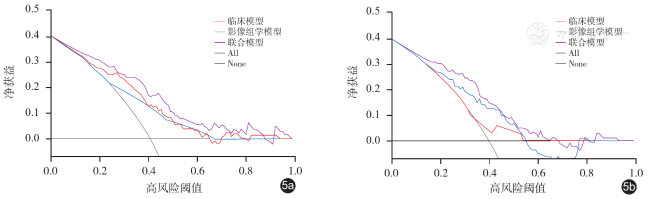
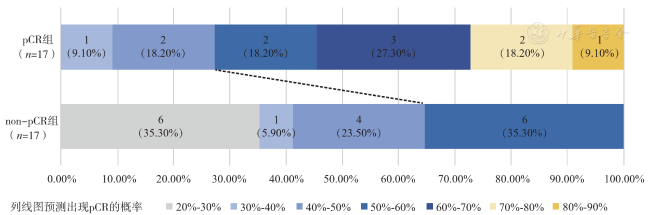
四、3种模型的效能评价及验证
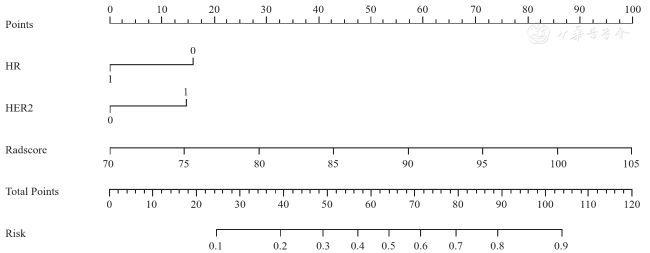
图7 联合模型预测乳腺癌患者新辅助化疗后病理完全缓解的列线图注:HR为激素受体状态(1代表阳性,0代表阴性);HER2为人类表皮生长因子受体2状态(1代表阳性,0代表阴性);Radscore为影像组学评分 |
表2 3种模型在训练集和验证集的预测性能 |
| 模型 | AUC(95%CI) | 特异度[%,(95%CI)] | 敏感度[%,(95%CI)] | 准确性(%) |
|---|---|---|---|---|
| 训练集(n=107) | ||||
| 临床模型 | 0.68(0.60~0.77) | 58.02(46.5~68.9) | 72.73(59.0~83.9) | 63.97 |
| 影像组学模型 | 0.75(0.67~0.83) | 56.79(45.3~67.8) | 87.27(75.5~94.7) | 69.12 |
| 联合模型 | 0.82(0.75~0.89) | 70.37(59.2~80.0) | 83.64(71.2~92.2) | 75.74 |
| 验证集(n=95) | ||||
| 临床模型 | 0.68(0.58~0.78) | 71.43(58.7~82.1) | 57.50(40.9~73.0) | 65.05 |
| 影像组学模型 | 0.72(0.62~0.82) | 80.95(69.1~89.8) | 55.00(38.5~70.7) | 69.90 |
| 联合模型 | 0.79(0.70~0.87) | 69.84(57.0~80.8) | 82.50(67.2~92.7) | 72.82 |
注:AUC为ROC曲线下面积;CI为置信区间 |